ГЛАВА XIII
СОСТАВЫ
Как общеизвестно, химические составы образуются в результате объединения двух или более химических атомов, которые демонстрируют, таким образом, новые структуры. При исследовании составов ясновидящий замечает, что атомы внутри состава обычно не остаются отделенными, а их составляющие части смешиваются, образуя новое вещество. Иногда химические атомы не теряют своей индивидуальности, оставаясь целостностью, а в других случаях наоборот, имеют очень разбросанный вид, но их характерные группы могут быть легко прослежены, если воспользоваться иллюстрациями, приложенными ранее.
Составы, которые были исследованы, размещены, насколько это возможно в связанных группах. Вначале идут составы, которые относятся к неорганической химии, за ними следуют составы органической химии.
Иллюстрации, диаграммы и фотографии моделей, использованные в этой главе, конечно же, не могут дать читателю полной информации о составе молекулы, так как это невозможно передать графически, поэтому изучающему придется полагаться в основном на интуицию и развитое воображение.
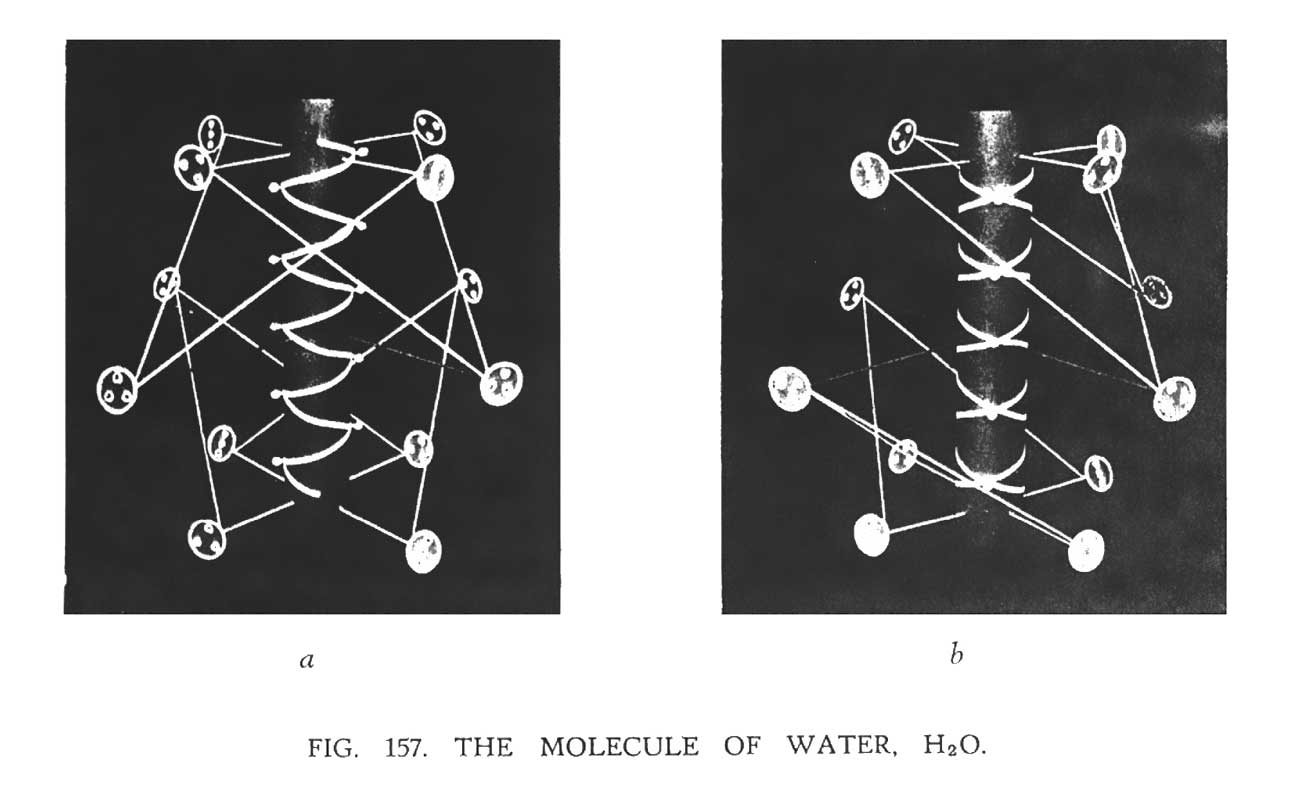
ВОДА (H2O)
Каждая молекула воды составлена из двух атомов водорода и одного атома кислорода. Рис. 157 показывает, что происходит при объединении этих атомов. Двойная спираль кислорода полностью сохраняет свою индивидуальность. Вокруг нее упорядоченно выстраиваются атомы водорода. На рис. 157a изображен процесс формирования общей сферы с атомами водорода и кислорода. Рис. 157b, демонстрирует фотографию той же модели, которая показывает, что, в конечном счете, атомы водорода также сохраняют свою индивидуальность, размещаясь надлежащим образом.
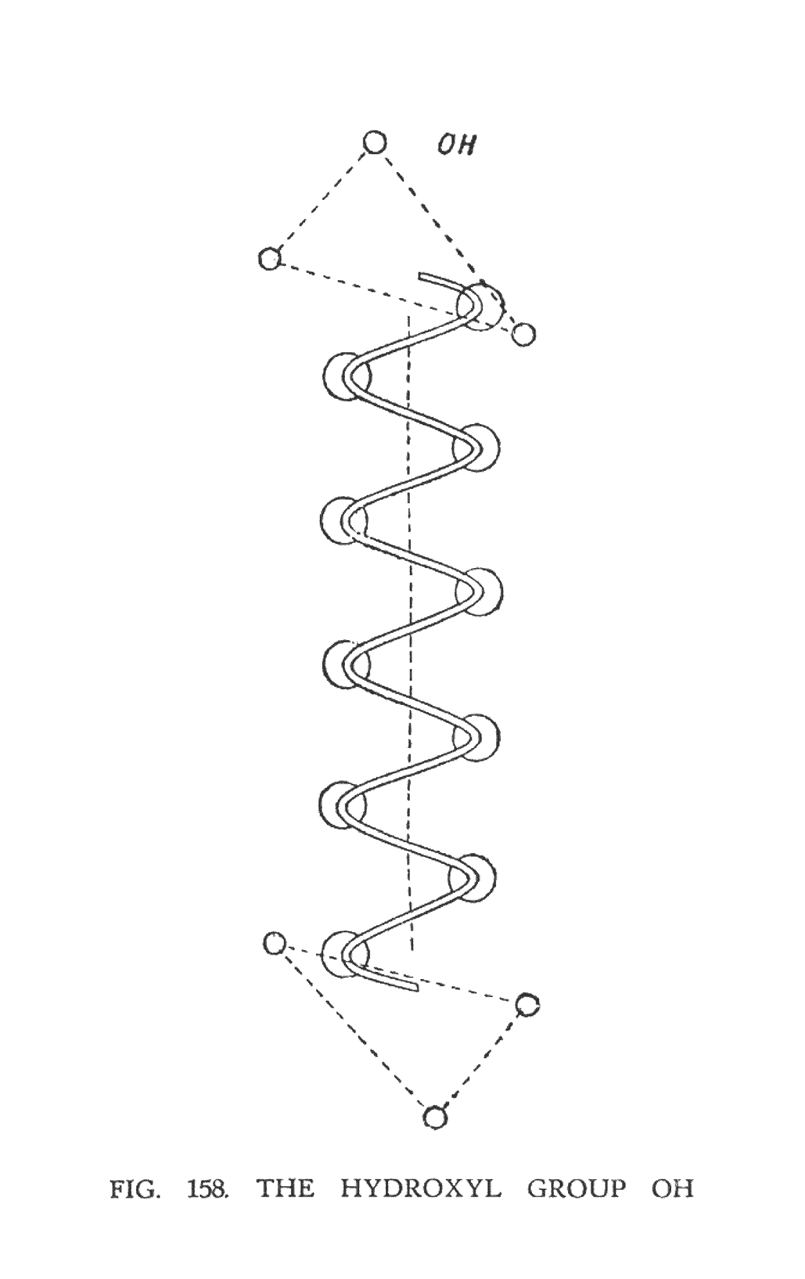
ГИДРОКСИЛЬНАЯ ГРУППА (ОН)
Эта группа обладает достаточной стабильностью, которая позволяет ей сохранять свою форму во многих составах. В центре гидроксильной группы расположена двойная спираль кислорода (рис. 158). Атомы водорода формируют два треугольника, которые расположены над и под спиралью. Верхний треугольник положителен, нижний-отрицателен. Хотя треугольники водорода отделены спиралью кислорода, между ними все еще сохраняется связь. Результирующая сила проходит через центр спирали и связывает все воедино. Образовавшаяся система находится в непрерывном вращении, которое происходит вокруг центральной оси. Треугольники быстро вращаются и при вращении немного вибрируют вверх и вниз, поскольку верхняя часть начинает вращение первой.
Стоит отметить, что когда формируется состав, входящие атомы очень часто разбиваются в группы, которые образуются при дезинтеграции элементов на четвертом уровне (E4). Это показывает важность изучения дезинтеграции элементов. Сделанные выводы наталкивают на мысль, что переход на четвертый уровень связан с определенными химическими изменениями.
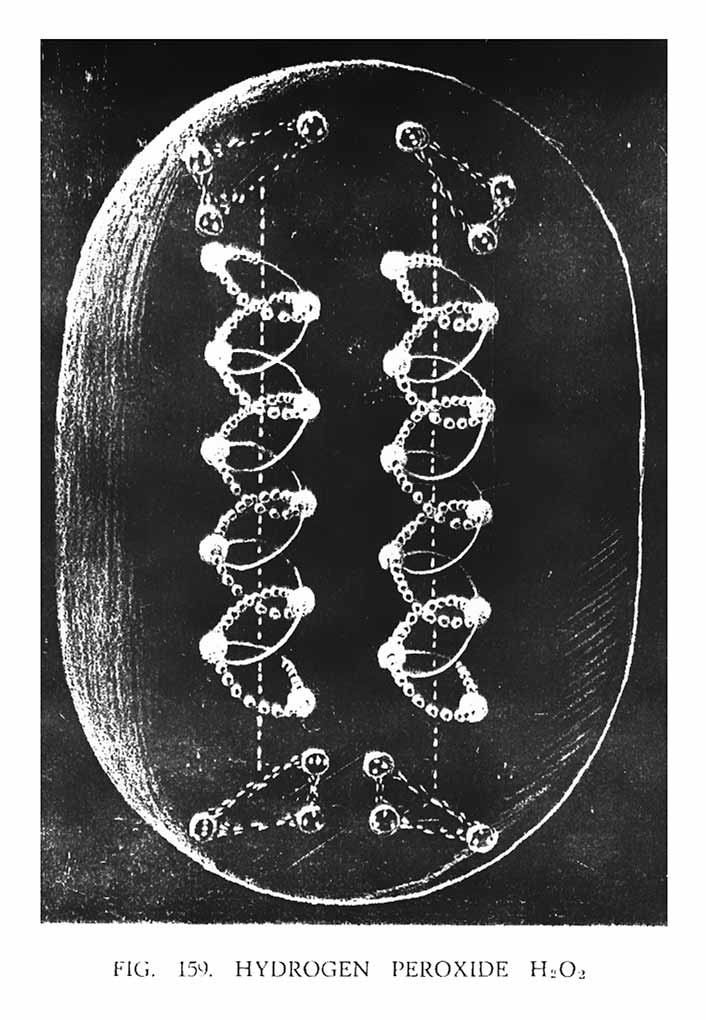
ПЕРЕКИСЬ ВОДОРОДА (H2O2)
Появление этого вещества связано, скорее всего, с появлением гидроксильной группы (ОН). Структурно они более идентичны, чем с молекулой воды (рис. 159). Изображая на иллюстрации атомы кислорода, художник преднамеренно не учел маленькие тела, состоящие из двух Ану, которые расположены внутри одной из спиралей. Это было сделано для того, чтобы передать кислороду больше графического смысла. Детализация в этом случае усложнила бы восприятие передаваемой идеи. На иллюстрации мы видим две спирали кислорода, расположенные вертикально друг к другу. Одна спираль имеет положительный заряд, другая отрицательный. Над и под спиралями атомы водорода сформировали свои треугольники, аналогично тому, как мы наблюдали, исследуя гидроксильную группу. Вначале создается впечатление, что верхние треугольники водорода не работают в единой системе, а сохраняют автономию. То же самое касается и двух спиралей кислорода. Но при определенных условиях, один атом кислорода, отсоединившись, направляется к водороду, в результате чего треугольники водорода начинают соединяться, образуя форму воды (H2O), как показано на рис. 157.
Возникает резонный вопрос, почему молекула H2O2 должна имеет такое непостоянство? Исследования показали, что имеется некий радиоактивный фон, который образуется на поверхности земли. Источник радиации исследован не был. Возможно этот процесс связан с влиянием солнца, а может радиоактивный фон пробивается из центра земли. Однозначно можно сказать, что был зафиксирован устойчивый поток радиации, который пробивается снаружи земли и направляется в атмосферу. Поскольку радиоактивный поток направлен вверх, в атмосферу, он захватывает верхние треугольники водорода, которые начинают интенсивное вращение. Обычно подобное воздействие не влияет на поведение молекулы, поскольку верхние и нижние треугольники водорода прочно связаны с атомом кислорода, и воздействие исходящей силы не достаточно сильно, для того, чтобы разорвать эту связь. Но поскольку треугольники, находясь в непрерывном вращении, образуют угол наклона, а исходящая сила, вмешиваясь, создает дополнительный момент, увеличивая угол наклона, вся система начинает терять равновесие и разрывается связь с нижним треугольником. Этот процесс можно сравнить с работой реактивного двигателя, в котором турбина начинает вращаться при интенсивном давлении пара на пластины колеса. То же самое, происходит и с верхним треугольником водорода. Когда происходит потеря равновесия, в результате интенсивного движения, атом кислорода теряет привычный ритм, в результате чего отдает один атом, который тут же направляется к верхнему треугольнику водорода, так как он находится ближе и имеет соответственно большее притяжение. В результате этого положительный треугольник получает дополнительную силу и может уже притянуть отрицательный, образуя молекулу воды. То же самое происходит и с нижним треугольником.
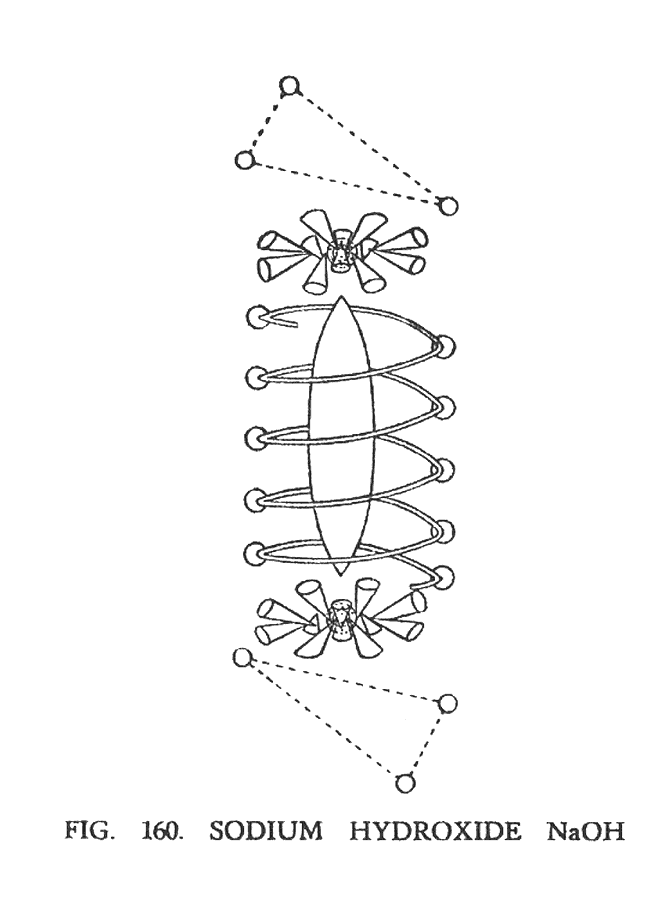
ГИДРОКСИД НАТРИЯ (NaOH)
Рассматривая гидроксильную группу (ОН) (Рис.158), мы уже имеем представление о расположении кислорода и водорода, а также об их совместной работе. Мы также говорили о стабильности этой группы, которая повторяется во многих составах. Натрий также был нами рассмотрен в главе IV "группа гири". Что получается в результате соединения этих составляющих показано на (рис. 160).
Центральная ветвь натрия находится внутри спирали кислорода, сохраняя с обоих концов плавающие воронки. Она свободно вращается внутри атома кислорода, не затрагивая его спиралей. Спираль кислорода немного сжалась в результате компрессии и стала короче.
Два треугольника — представители водорода, разделены и находятся над и под воронками натрия, подобно тому, как было описано при исследовании гидроксильной группы (ОН). Связь между ними не нарушилась, хотя стала слабее в результате взаимодействия натрия. Подобную картину мы будем наблюдать позже, исследуя соляную кислоту (HCl), в которой увидим как происходит подобное разрушение водородной связи. Причиной этого, вероятно, является интенсивное действие натрия, которое было замечено ясновидением и которое, по всей видимости, также влияет на качество горения.
Интересно, что все химические комбинации, исследованные ясновидением, производят глубокое впечатление, которое невозможно описать чисто механическим взаимодействием. Создается впечатление, что они живые. Они демонстрируют элементарные чувства, которые хотя и рудиментарны, но производят реакцию в наблюдателе. Таким образом, любой наблюдатель, даже без элементарной химической подготовки, обратил бы внимание, что происходит при горении натрия. В результате этого действия создается подсознательное чувство вины, оставляя неприятное впечатление, когда видишь картину происходящего.
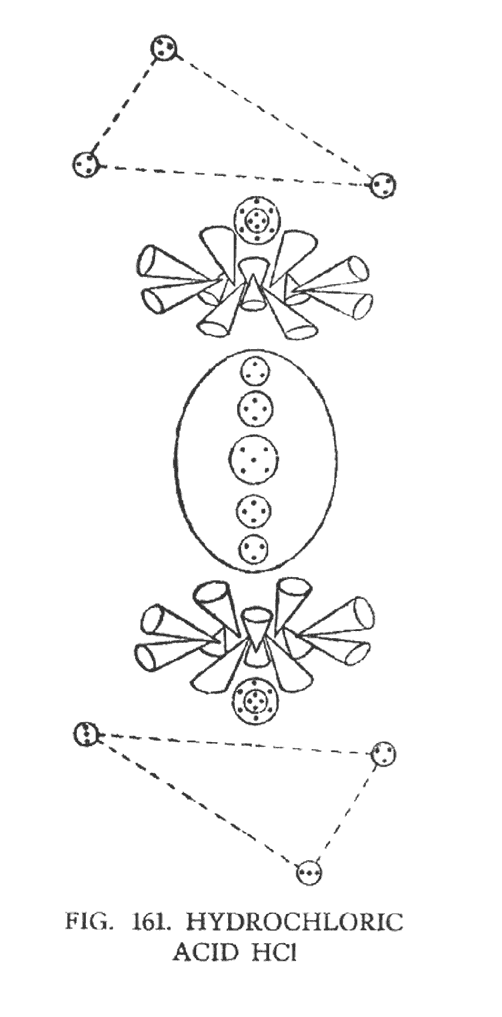
СОЛЯНАЯ КИСЛОТА (HCl)
Атом водорода, объединяясь с атомом хлора, образуют молекулу вещества, которое мы называем соляная кислота. Хлор, как и натрий, относится к группе "гири", исследованной нами в четвертой главе этой книги. Слияние водорода и хлора показано на рис. 161.
Так как при взаимодействии водорода и хлора характер распределения сил меняется, вещества, находящиеся в составе, подвергаются некоторым изменениям. Таким образом, центральная ветвь хлора становится короче, в результате незначительной компрессии со стороны действующих сил. Две сферы, содержащие по десять Ану, изменяют свое местоположение и перемещаются вплотную к треугольникам водорода. Это связано с тем, что треугольники водорода, вращаясь, создают мощное поле, которое захватывает центральные шары хлора, имеющие недостаточно прочную связь.
Два треугольника в атоме водорода при нормальных условиях имеют устойчивую связь. В гидроксильной группе связь между треугольниками ослабевает, так как между ними проходит кислородная спираль. В соляной кислоте между треугольниками вписывается хлор, который еще более нарушает устойчивую связь. Центральные шары хлора, состоящие из десяти Ану, имеют связь с небольшой сферой, содержащей пять Ану. Она находится в центре соединительной ветви и является главным центром хлора. Благодаря такой связи центральные шары, вокруг которых выстраиваются воронки, сохраняют устойчивое положение, находясь на определенном расстоянии от центральной перемычки. Но когда треугольники водорода начинают вращаться, связь с центральной группой хлора ослабевает, и шары перемещаются к элементам водорода. Такой процесс продолжается недолго, и через какое-то время центр хлора возвращает шары на место. Атом хлора напоминает пружину, которая растягивается до определенной степени, а потом сжимается. Рис. 161 показывает процесс "растягивания пружины". Вероятно, в результате такого взаимодействия разъедающая сила кислоты может варьировать.
Рассматривая соляную кислоту, мы заметили любопытную деталь. Она заключается в том, что в соляной кислоте воронки находятся ближе к центру (Na 10), чем в отдельном атоме хлора.
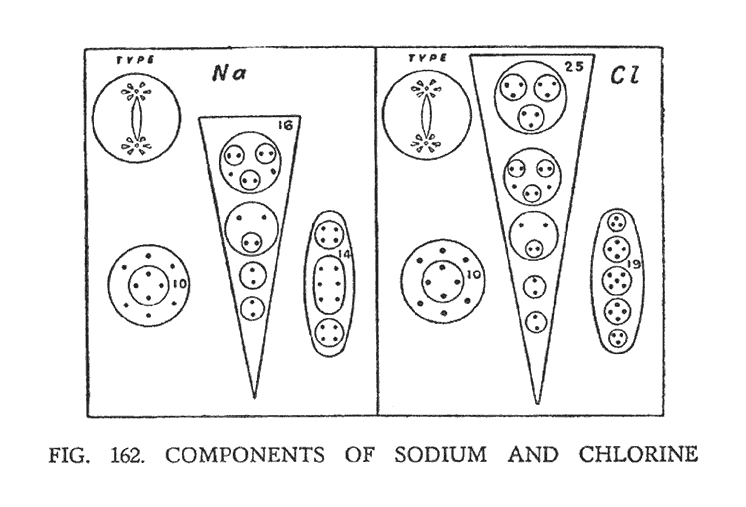
ХЛОРИД НАТРИЯ ИЛИ ПОВАРЕННАЯ СОЛЬ (NaCl)
Молекула поваренной соли (NaCl), состоит из одного атома натрия и одного атома хлора. Оба элемента относятся к группе "гири", которую мы уже рассматривали ранее. Каждый из них состоит из центральной ветви, на концах которой расположены центральные шары. Вокруг шаров вращаются двенадцать воронок. Более детальное описание этих элементов уже производилось. В результате соединения натрия и хлора некоторые группы терпят изменения, приведенные на (рис. 162).
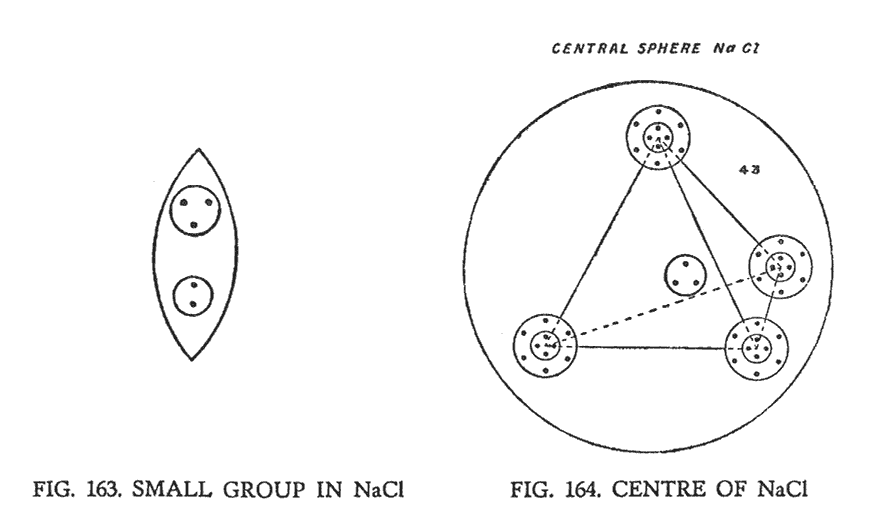
Таким образом, группа, состоящая из шести Ану, расположенная в центре соединительной ветви натрия, перекомбинирует свои атомы, размещая их в два ряда. Эта группа имеет положительный заряд и является центром химического атома.
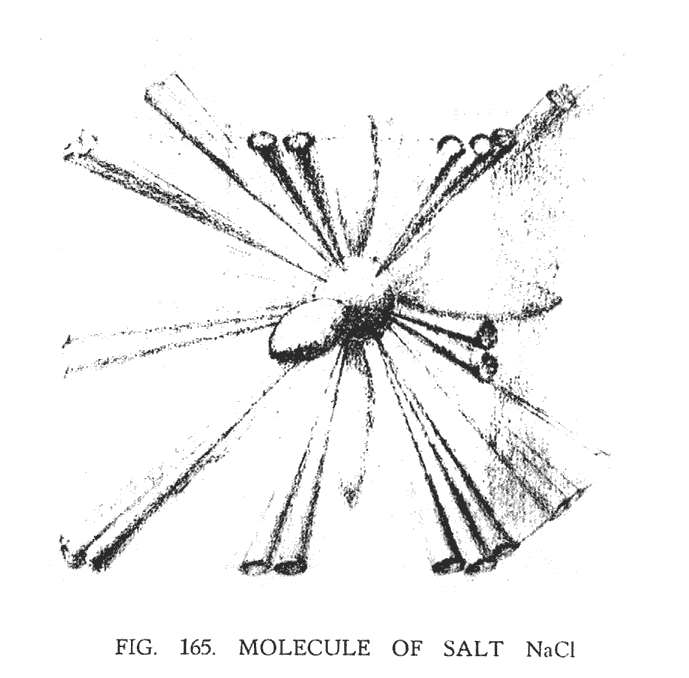
Когда натрий и хлор объединяются, создавая молекулу соли, их компоненты выстраиваются таким образом, что наблюдатель видит в пространстве модель куба (рис. 165). Двадцать четыре воронки хлора, исходящие из центра куба, объединяясь в триады, теперь направлены на восемь его углов. А двадцать четыре меньшие воронки натрия, группируясь парами, направлены к двенадцати средним точкам, расположенным на каждой грани куба. Перкомбинация элементов происходит в соединительных перемычках, а также в сферах, расположенных на концах "гирь". Группы, содержащиеся в двух соединительных перемычках, теперь исходят из центра и смотрят на шесть сторон куба. На (рис. 163). они изображены вместе с центром (рис. 164).
Подсчитывая Ану в натрии и хлоре, мы получили следующее:
| Поваренная соль | ||
|---|---|---|
| 24 воронки хлора, направленные к углам куба | = | 600 Ану |
| 24 воронки натрия, направляет к граням куба | = | 384 Ану |
| 6 групп по 5 Ану, направленные к сторонам куба | = | 30 Ану |
| Центральный шар | = | 43 Ану |
| Общее количество | = | 1057 Ану |
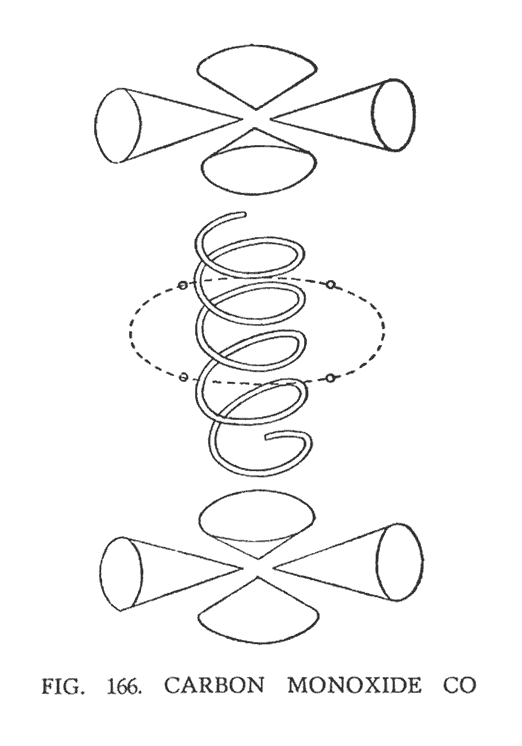
ОКИСЬ УГЛЕРОДА (СО)
Окись углерода — это простая комбинация углерода и кислорода. Напомним, что углерод представляет собой группу из восьми воронок, которые направлены на восемь сторон октаэдра. Четыре воронки положительны и четыре отрицательны. Каждую пару воронок связывает соединительный Ану. Главный центр окиси углерода — четыре атома, не связанные друг с другом.
Когда углерод объединяется с кислородом, он разбивается на две группы воронок как показано на (рис. 166).
Атом кислорода остается без изменений, располагаясь вертикально. Вокруг него, подобно спутникам движутся соединительные Ану, оторвавшиеся от углерода. Восемь воронок углерода самостоятельно разбиваются на две группы, по четыре воронки в каждой, располагаясь над и под спиралью кислорода. Четыре воронки, две из которых имеют положительный заряд и две отрицательный, вращаются в горизонтальной плоскости. В результате изменения характера распределения сил, воронки усечены и имеют сглаженную, грушеобразную форму по сравнению с натуральным видом. Нужно иметь в виду, что окись углерода была исследована оккультно, то есть не лабораторным методом. Исследователь-ясновидец, изучая двуокись углерода (СО2), удалил из нее один атом кислорода, в результате чего частицы выстроили новую модификацию — СО. Получившаяся таким образом новая молекула была исследована.
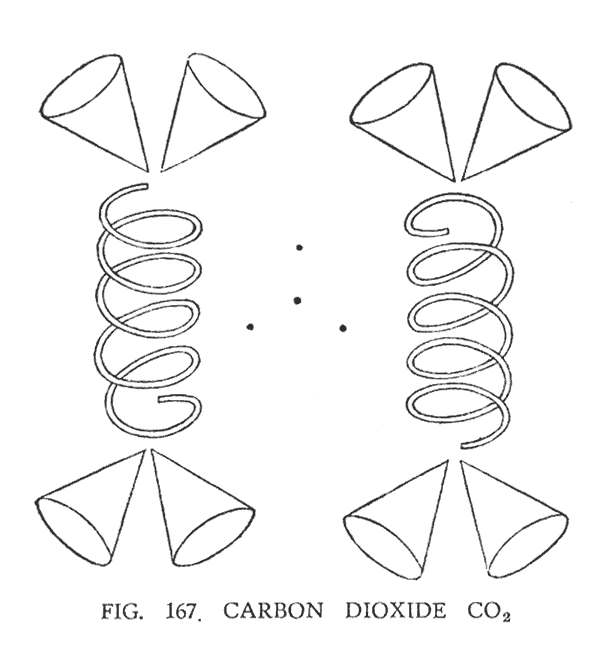
ДВУОКИСЬ УГЛЕРОДА (СО2)
В этой комбинации мы имеем один атом углерода и два атома кислорода. Наглядно это изображено на (рис. 167).
Два атома кислорода вращаются вокруг общего центра, который составлен из четырех свободных Ану, формирующих центр углерода. Четыре Ану расположены не в углах тетраэдра, как это может показаться, а немного искоса вокруг центрального Ану.
С обоих концов каждого атома кислорода, размещены две воронки углерода. Они не вращаются в горизонтальной плоскости, как воронки окиси углерода, а придерживаются ближе к вертикальной позиции.
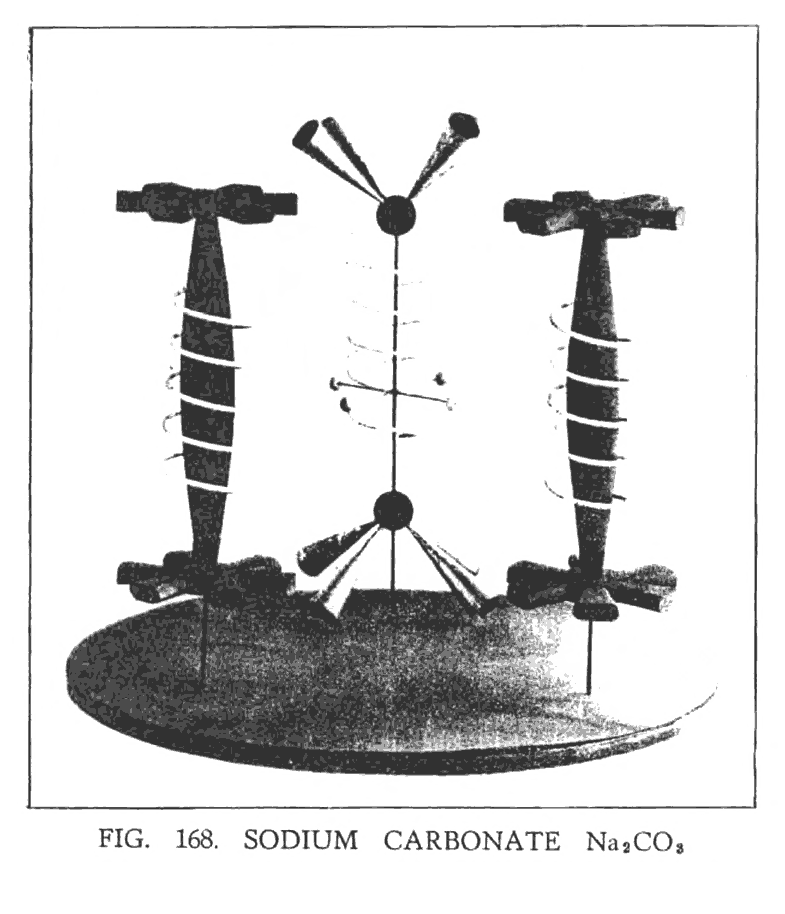
КАРБОНАТ НАТРИЯ (Na2CO3)
Исследовав комбинацию углерода с одним и с двумя атомом кислорода, мы решили расширить диапазон исследований, рассмотрев комбинации углерода с тремя атомами кислорода. Углерод с тремя атомами кислорода (CO3) отдельно не существует но, рассматривая его в составе с натрием, он становится легко доступный для исследования. Итак, для анализа был взят карбонат натрия (Na2CO3), в котором содержатся два атома натрия, один атом углерода и три атома кислорода. Схематически эту молекулу изображает модель, приведенная на (рис. 168).
Главный центр всей молекулы — четыре свободных Ану, отделившиеся от воронок углерода. Каждый атом натрия и атом углерода, подобно змее, обвивает спираль кислорода. Химические атомы, располагаясь в пространстве, образуют треугольник, в котором углерод является вершиной. Таким образом, два атома натрия разместились внутри двух спиралей кислорода, а атом углерода с восемью воронками занял свое место внутри третьего атома (рис. 168).
Стоит обратить внимание, что подобная треугольная зависимость была выведена Брэггом из его анализа рентгена кальцита и арагонита, в которых зарождается группа CO3.
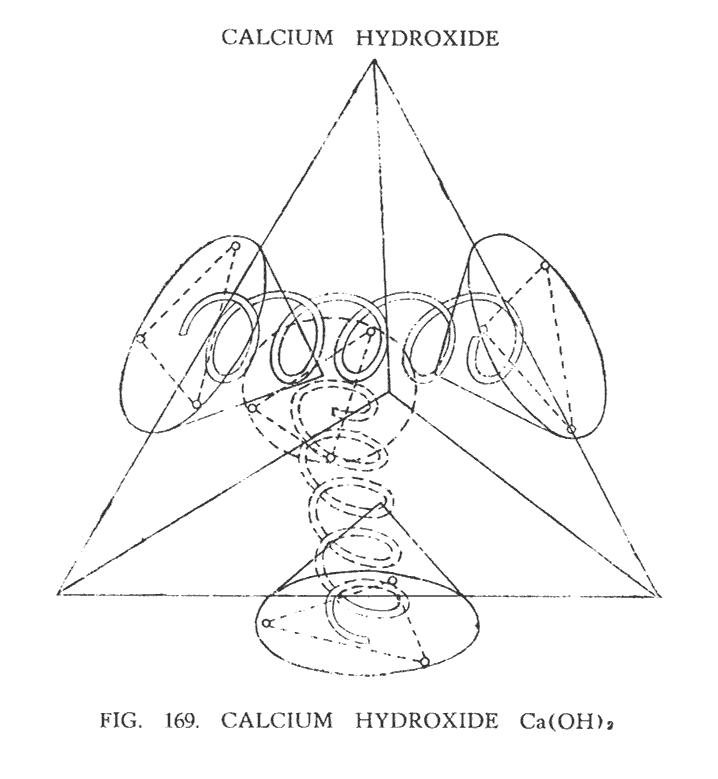
ГИДРОКСИД КАЛЬЦИЯ (Ca (OH)2)
Кальций — двухвалентный элемент. Благодаря исследованиям, в которых был использован метод ясновидения, было установлено, что он имеет четыре воронки, лежащие в центре одной из четырех сторон тетраэдра. Центр кальция — сфера, содержащая 80 Ану, от которой отходят четыре воронки, содержащие 160 Ану каждая.
Гидроксильная группа (ОН) была исследована в этой главе, а также изображена на (рис. 158). Вспомнив основные моменты ее структуры, мы сможем без затруднений двигаться дальше.
Рассматривая (рис. 169), мы можем наглядно представить, что получается в результате соединения этих элементов. Каждая гидроксильная группа формирует ложную связь между двумя воронками кальция, располагаясь под прямым углом относительно двух создавшихся пар. Такое расположение можно было бы назвать истинным, если бы связь между воронками оставалась постоянной. На рисунке мы видим два атома кислорода, пересекающие друг друга под прямым углом, на концах которых находятся треугольники водорода, плоскость которых вписывается в раструбы воронок. Второй атом кислорода и треугольник водорода не могут быть замечены на иллюстрации, поскольку они скрыты за боковой гранью. Однако, предположительное их расположение показано пунктирными линиями. Центральная сфера кальция остается центром молекулы, однако, для простоты и наглядности она не изображалась на иллюстрации.
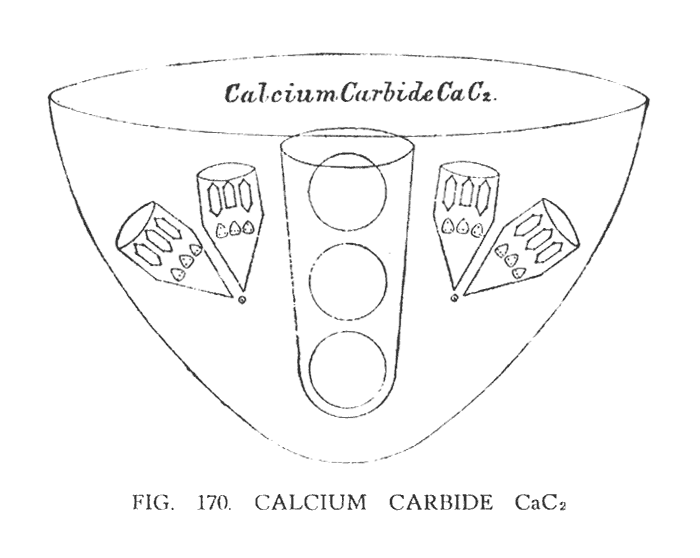
КАРБИД КАЛЬЦИЯ (CaC2)
Рассматривая карбид кальция (рис. 170). , мы видим один атом кальция и два атома углерода. В составе молекулы каждый атом углерода делится на четыре сегмента. Каждый сегмент состоит из одной положительной и одной отрицательной воронки углерода, связанных соединительным Ану.
Кальций состоит из четырех воронок, расположенных на каждой плоскости тетраэдра и направленных к центру. В комбинации CaC2, центр кальция остается неизменяемыми, но каждая воронка расширяется, для того чтобы создать место для воронок углерода (рис. 170). На иллюстрации изображена одна из четырех воронок кальция.
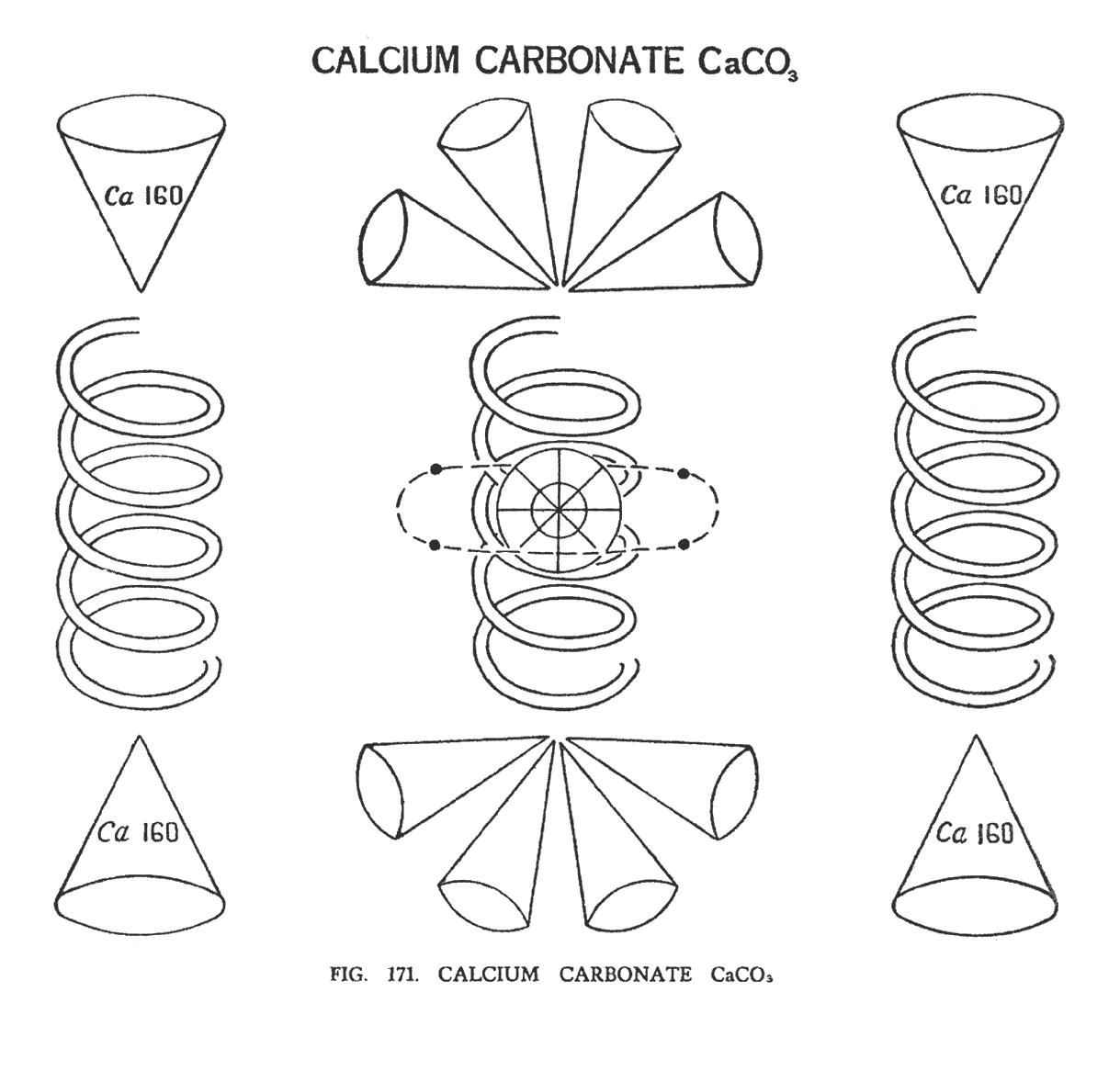
КАРБОНАТ КАЛЬЦИЯ (CaCO3)
В карбонате кальция центральный шар не разбит и является центром всей молекулы, составные части которой смоделированы аналогично карбонату натрия, в котором три атома кислорода сформировали три столбца в каждом угле треугольника. Мы также наблюдали, что элементы натрия находились внутри спиралей кислорода, при этом прибывая в непрерывном движении. Теперь мы снова наблюдаем три столбца, сформированные кислородом, но каждый столбец уникально связан с частью кальция или углерода (рис. 171).
Как уже было замечено, центральный шар (Ca 80), находится в центре молекулы, а четыре соединительных Ану углерода покинули свои воронки и теперь, подобно спутникам, вращаются вокруг нового центра. Центральный столбец имеет восемь воронок углерода, уже без соединительных Ану. Четыре воронки находятся сверху и четыре снизу. Соседние столбцы, над и под атомом кислорода имеют воронку кальция (Ca160). Таким образом, воронки кальция разделены атомами кислорода. Три атома кислорода, формируя треугольник, вращаются вокруг своей оси, а также вокруг центра треугольника. Центр кальция немного вдавлен в центр столбца, но это не показано на иллюстрации.
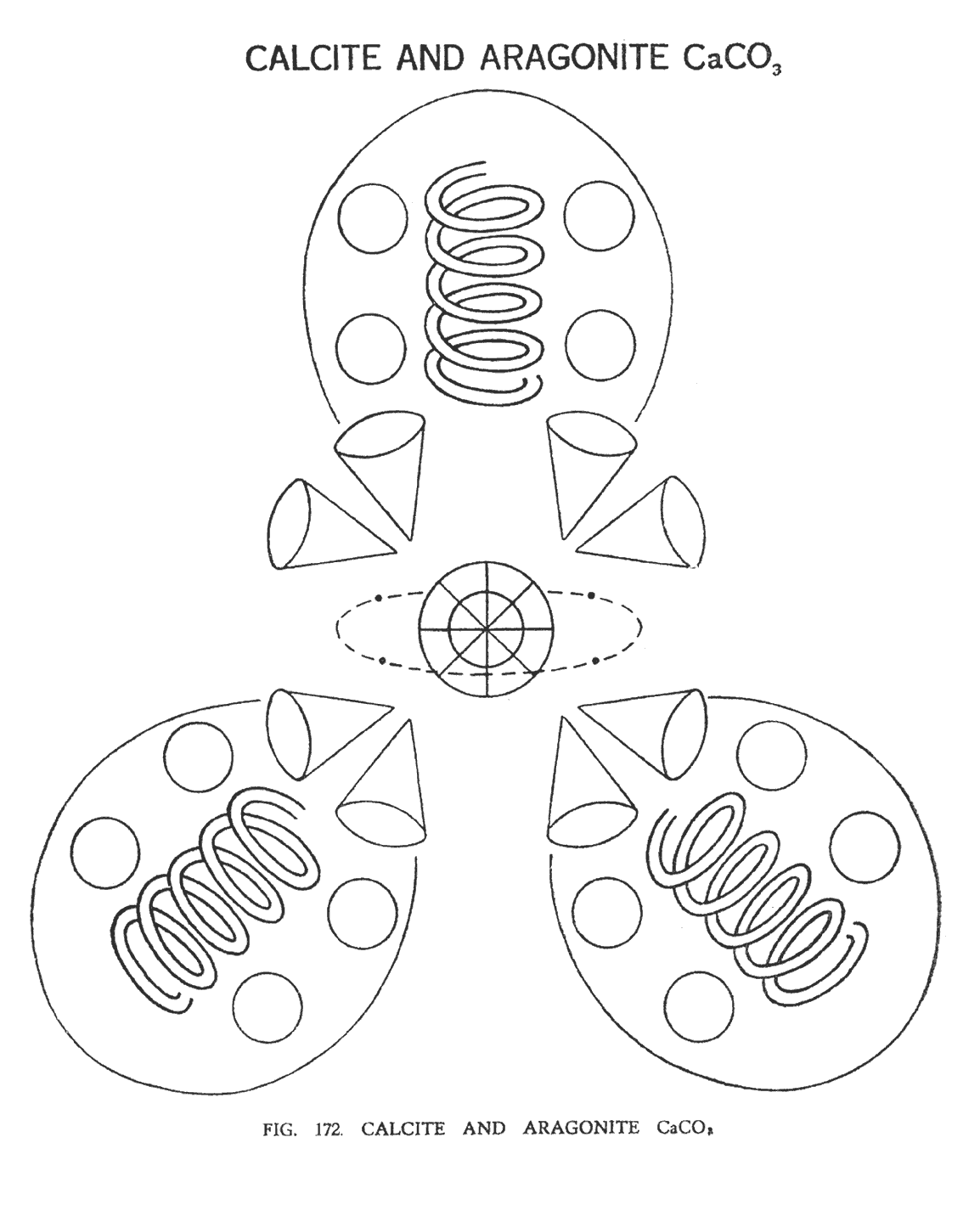
КАЛЬЦИТ И АРАГОНИТ (CaCO3)
Кальцит и арагонит — производные формы карбоната кальция. На (рис. 172). , видно, что три атома кислорода, некогда образующие столбцы, теперь образуют треугольник. В центре треугольника — группа Ca 80, с четырьмя свободными атомами углерода. Четыре воронки кальция разбиваются, образуя сферы. Каждая воронка (Ca160), содержит три сферы. Таким образом, всего мы имеем 12 сфер, которые располагаются по 4 вокруг каждого атома кислорода. Восемь воронок углерода размещены симметрично вокруг центра.
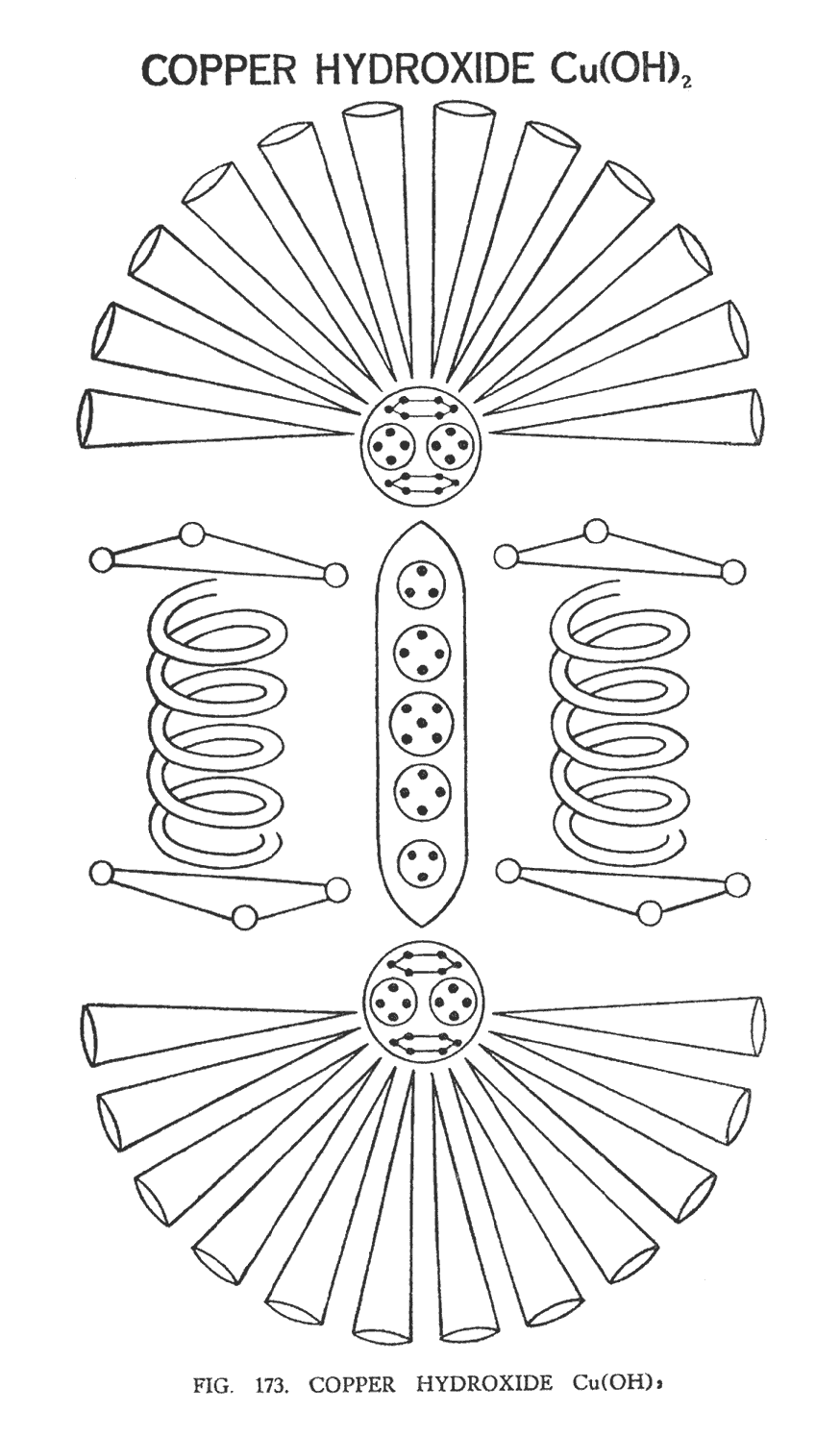
ГИДРОКСИД МЕДИ (Cu (ОН)2)
Эта молекула напоминает плод манго в разрезе (рис. 173). Атом меди, который относится к группе "гири", занимает центральную позицию на иллюстрации. Центральная ветвь, или соединительная перемычка, в результате изменения характера распределения сил, удлиняется и становится тоньше. На концах перемычки, подобно двум чугунным шарам гантели, расположены центральные шары — группы Cu20. Поскольку воронки имеют довольно сложную структуру, они длинны и простираются от центральных шаров на внушительное расстояние. Под воронками меди, с обеих сторон от центральной перемычки, располагаются две гидроксильные группы (ОН). Это напоминает открытый зонтик, если отбросить нижние воронки, под которым с обеих сторон от ручки спрятались гидроксогруппы. Вся композиция, находясь в движении, имеет очень красивую форму.
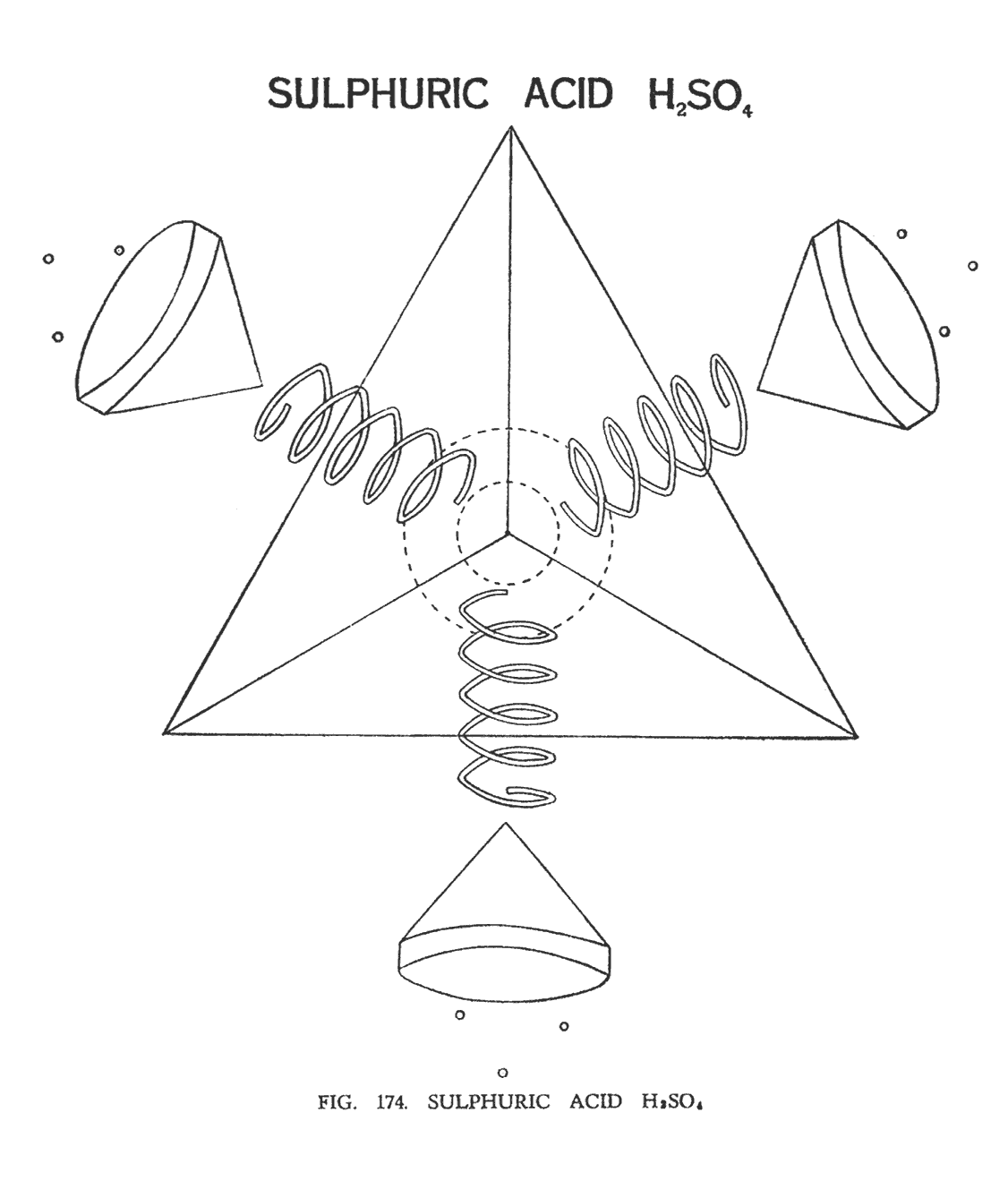
СЕРНАЯ КИСЛОТА (H2SO4)
Атом серы — тетраэдр группы В. Он состоит из четырех воронок, разбитых на три ячейки. Каждая ячейка содержит три ланцетные группы S 16. Всего девять ланцетных групп в одной воронке.
В молекуле H2SO4 атомы кислорода, как и обычно, разбивают атомы серы, занимая центр, и, выталкивая воронки серы, за его пределы (рис. 174). Четыре спирали кислорода (на иллюстрации четвертая спираль скрыта за боковой гранью тетраэдра и показана пунктирными линиями вместе с воронкой серы), располагаясь на каждой стороне тетраэдра, подобно огню факела удерживают четыре воронки серы. Над раструбом каждой воронки расположились треугольники водорода.
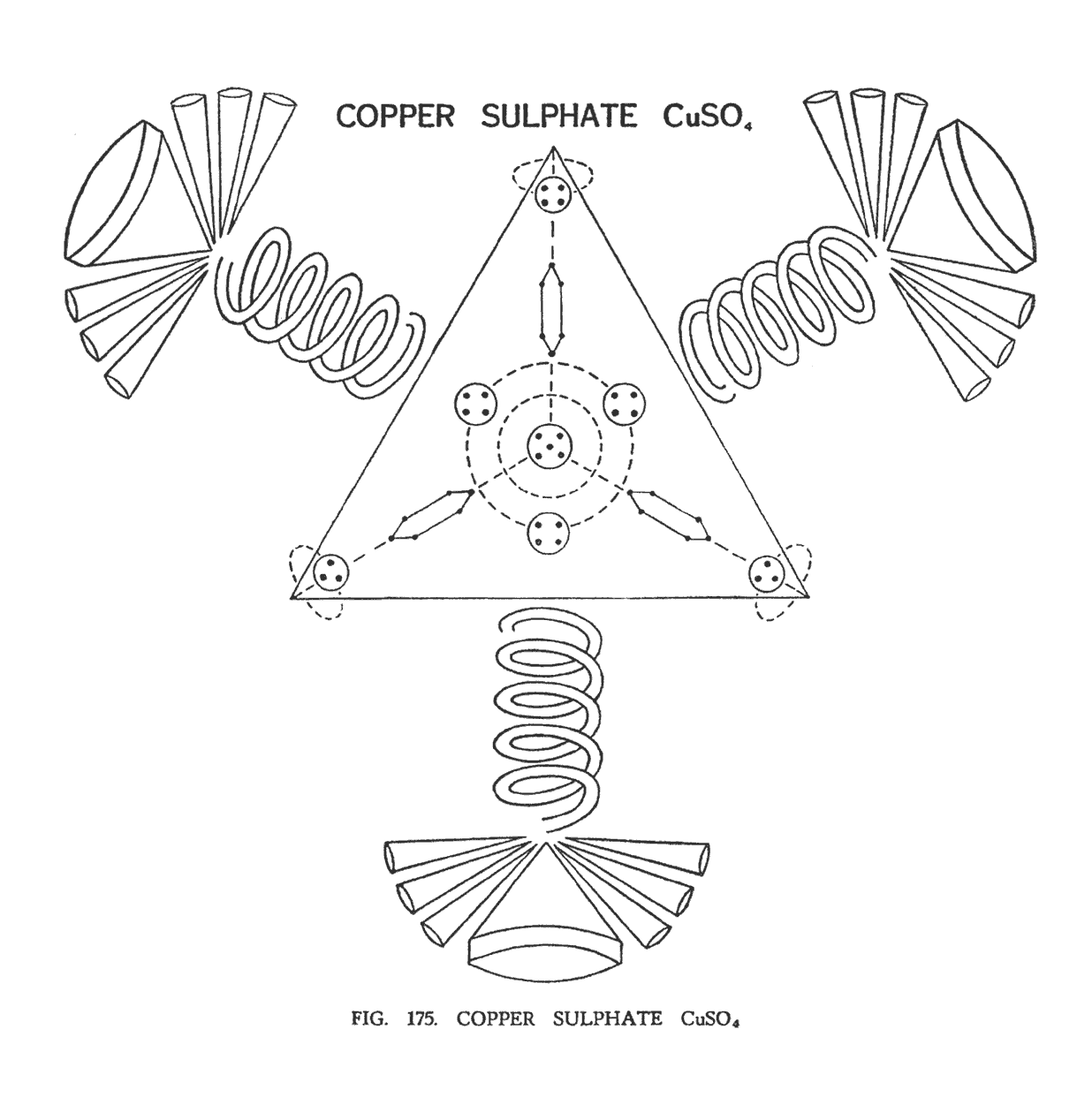
СУЛЬФАТ МЕДИ (CuSO4)
Молекула сульфата меди построена по прототипу молекулы серной кислоты. Как и в серной кислоте, четвертая спираль кислорода с воронками серы и меди не видна за боковой гранью тетраэдра и показана пунктирными линиями. Не будем забывать, что тетраэдральная форма образуется благодаря уникальному расположению первичных атомов в пространстве, но не в коем случае не является фактической границей (рис. 175).
Главным центром сульфата меди является сфера, содержащая пять Ану, находившаяся в центре соединительной перемычки. Вокруг этой сферы, подобно лучам солнца, отходят четыре ланцетные группы (Ad6), направленные на углы тетраэдра. Они заимствованы от двух центральных шаров меди. Четыре сферы, содержащие четыре Ану, также прибывающие в центральных шарах, теперь разбросаны по сторонам тетраэдра. Таким образом, появляется целый центральный комплекс, который работает как независимый модуль, хотя и не заключенный ограничивающей сферой.
Не рассмотренными у нас остались четыре группы, находившиеся в соединительной ветви меди. Они нашли свое место в четырех углах тетраэдра. Интересно, что эти группы ведут себя необычным образом, вращаясь вокруг углов тетраэдра. Вначале вокруг одного угла, затем вокруг другого, как бы вальсируя при этом. Наблюдатель задается вопросом, могут ли эти группы, значительно отдалившись, не вернуться к своим углам? Экспериментальным путем была сделана попытка отдалить эти группы от углов тетраэдра, но они с огромным рвением возвращались обратно.
От центра-модуля, созданного группами меди, отходят четыре спирали кислорода, пронизывая стороны тетраэдра. На концах спиралей, как и в серной кислоте, подобно тычинкам цветка расположены воронки серы, а вокруг них, подобно лепесткам — шесть воронок меди, прибывающие в группах по три и направленные раструбами от центра.
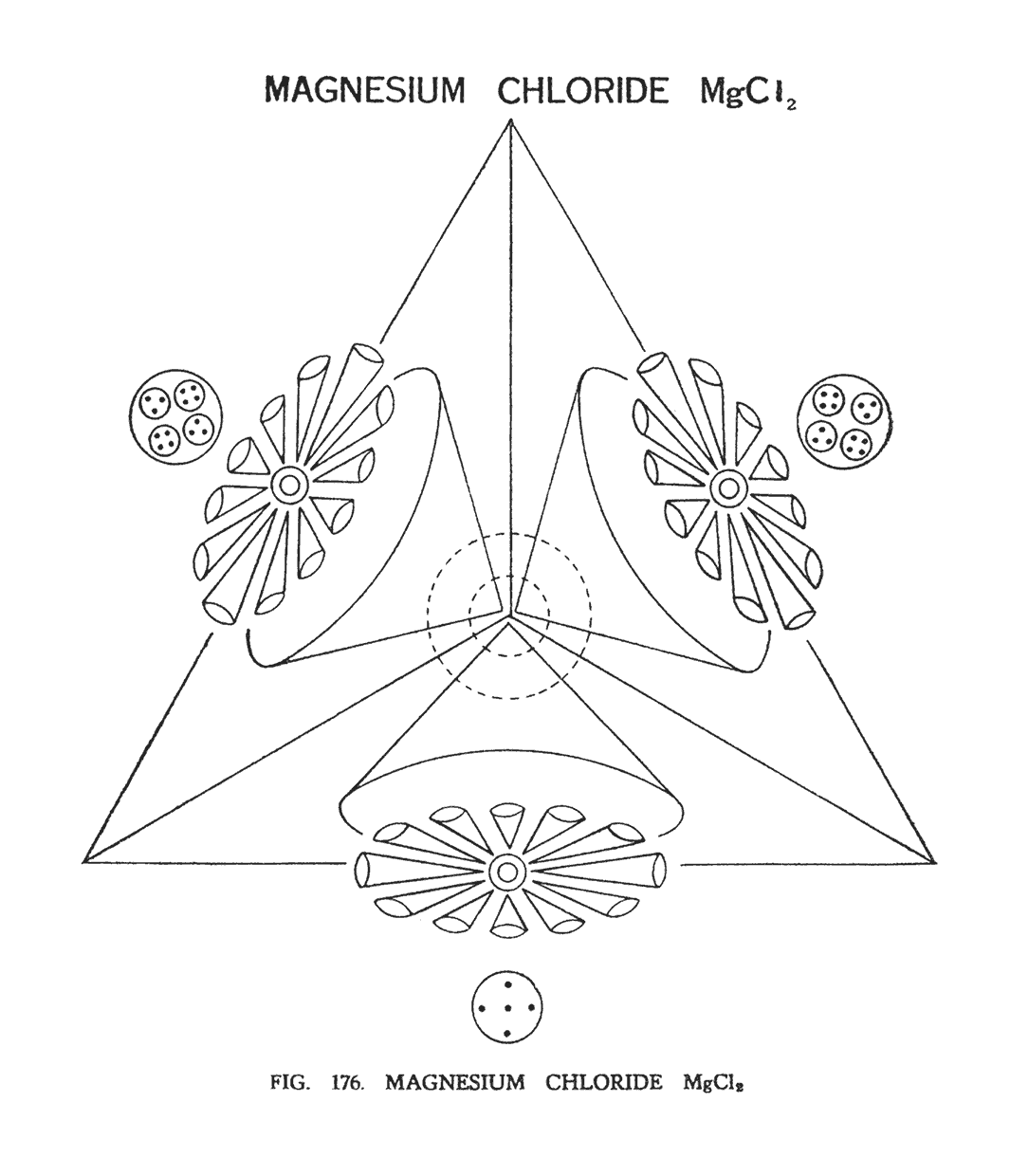
ХЛОРИД МАГНИЯ (MgCl2)
Рассматриваемая молекула (рис. 176) не имеет центра. Четыре широкие воронки магния, разделенные на три сегмента, просто образуют совокупность, имитируя форму тетраэдра.
Атом хлора имитирует форму гирь. Центр атома хлора — группа-сфера, содержащая пять Ану, расположенная в центральной перемычке или ветви. Эта сфера, как было описано, имеет положительный заряд и жестко держит занятые позиции. Отрицательные частицы более мягки и податливы. При дезинтеграции хлора тело, содержащее пять Ану, вместе центром и первой группой воронок направляется к отрицательной воронке магния и начинает кружить над ней. Четыре латеральные сферы, присутствующие в центральной ветви, вместе со второй группой воронок и центром направляются к положительной воронке магния. Эти четыре тела, образуя группу, вращаются вокруг общего центра. После того как атомы упорядочены, создается интересная композиция. 12 воронок хлора, напоминающие формой лепестки цветка, ведут себя как самостоятельный модуль, вращаясь вокруг собственного центра.
Таким образом, хлорид магния состоит из двух отрицательных воронок, над которыми подобно цветку вращаются воронки хлора, привлекающие две группы из пяти Ану, и двух положительных воронок, над которыми также вращаются воронки хлора, привлекающие, две группы, содержащие 14 Ану.
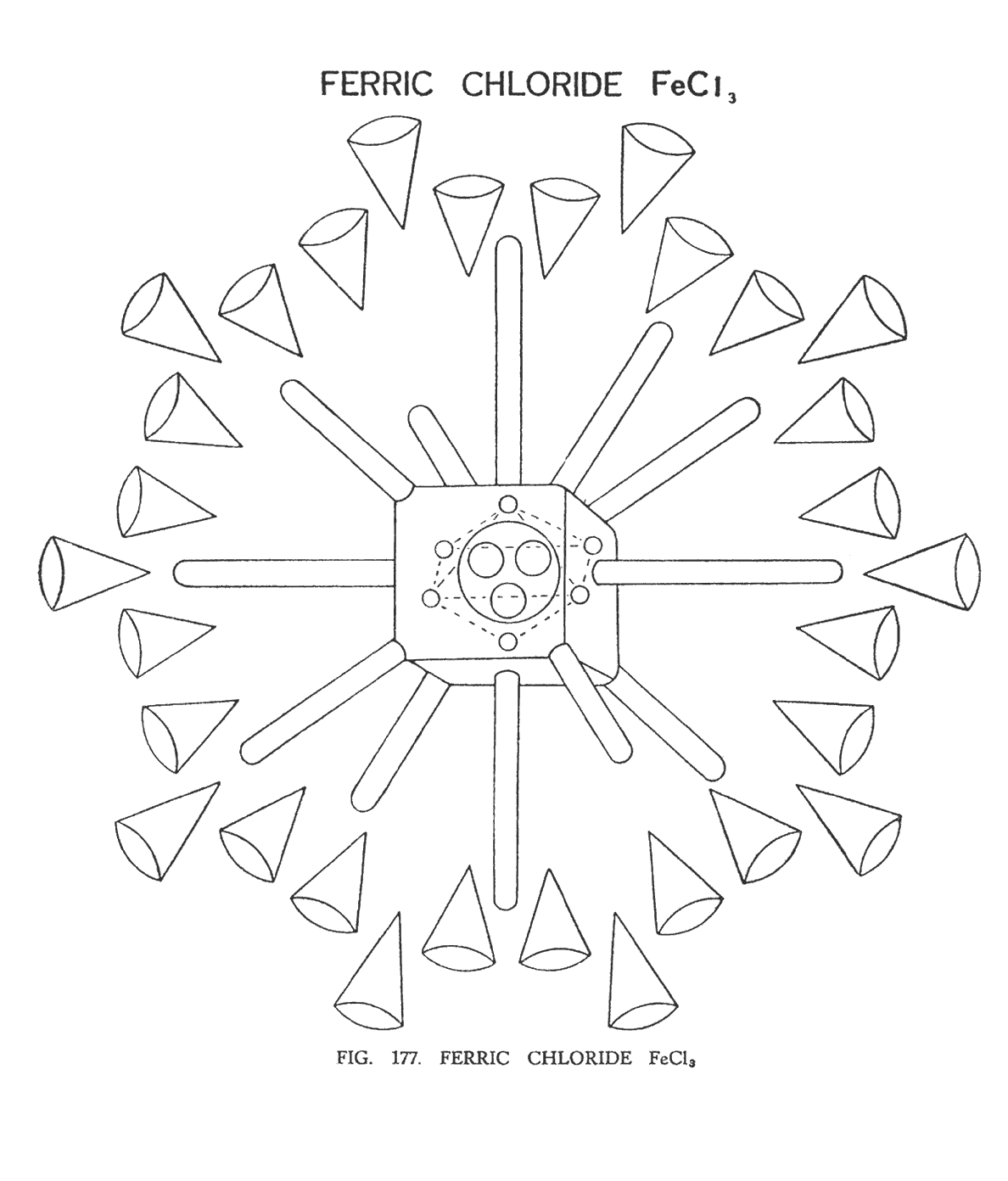
ХЛОРИД ЖЕЛЕЗА (FeCl3)
Как мы помним из прошедшего материала, железо состоит из семи болванок или четырнадцати областей, которые со всех сторон пронизывают вымышленный куб. Три атома хлора, демонстрируют нам три соединительные перемычки (3Cl19), формирующие центр гирь, шесть центральных шаров, каждый с центром Na10, и двенадцатью воронками, общая сумма которых достигает семьдесят двух штук.
В молекуле FeCl3, (рис. 177) три соединительные ветви хлора, перекомбинируясь, образуют три сферы и занимают центр куба. Вокруг них вращаются шесть центров Na 10, образуя октаэдр. Они размещены таким образом, что не выходят за границы куба. Весь модуль работает как единая система и образует главный центр в атоме железа. Болванки железа лежат на поверхности сферы. (рис. 177)
На иллюстрации невозможно показать все семьдесят две воронки, поэтому изображены только 36. Они группируются по три в каждой группе и предназначены, для того, чтобы предать составу определенную агрегацию.
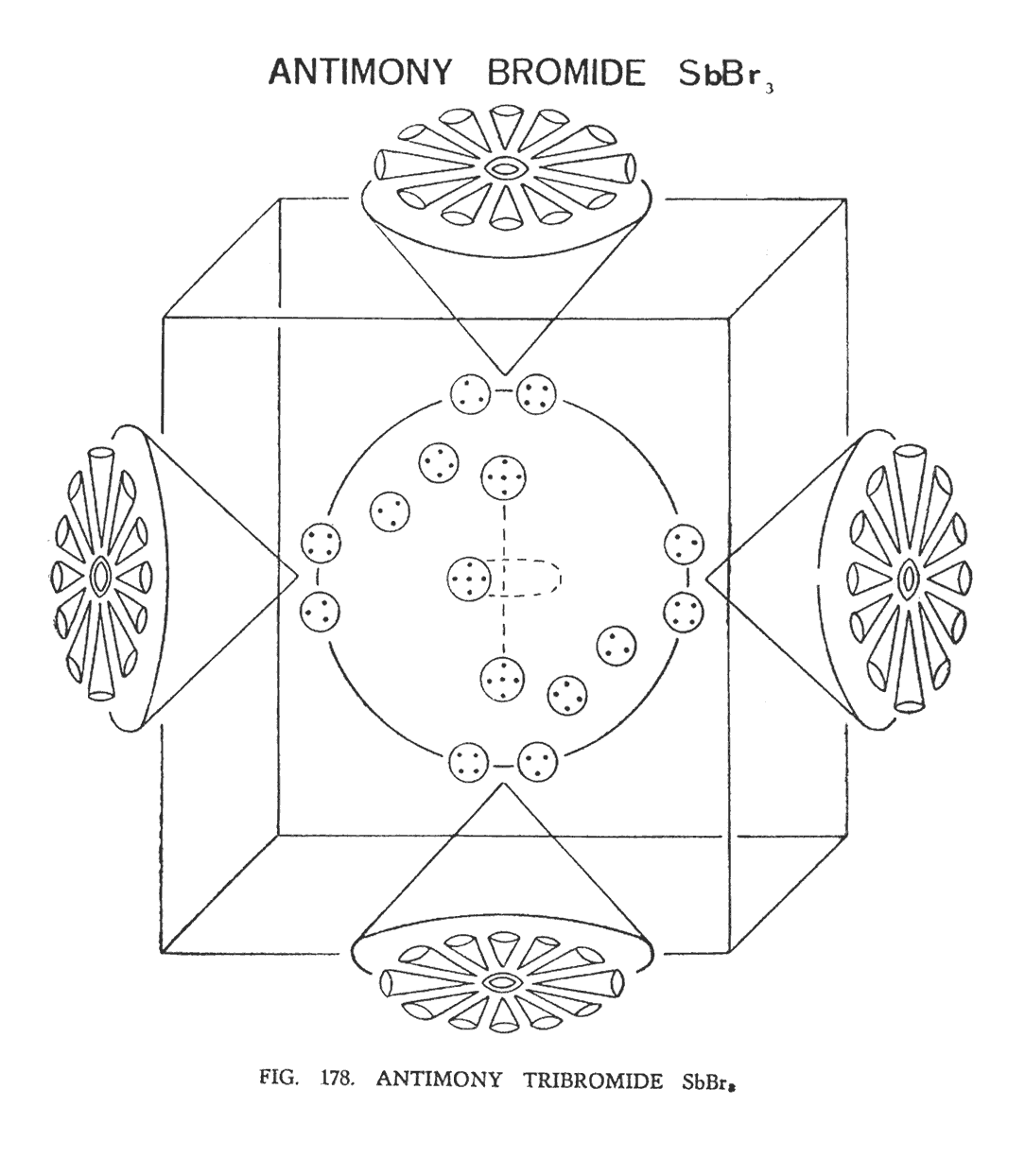
ТРЕХБРОМИСТАЯ СУРЬМА (SbBr3)
Напомним, что сурьма относится к группе "кубы". Она имеет шесть воронок без какого-либо центра.
Бром относится к группе "гири". Его атом состоит из соединительной перемычки, аналогичной хлору (Cl 19), двух центральных шаров или сфер, и двенадцати воронок, отходящих от каждой сферы.
В трехбромистой сурьме элементы брома, некогда формировавшие соединительные ветви, направляются к центру куба и формируют главный центральный модуль всей молекулы (рис. 178)
Воронки брома вместе с центральными шарами разбиваются, группируясь по 12 штук над каждой воронкой сурьмы в виде лепестков цветка. На (рис. 178) изображено лишь четыре из шести воронок.
Как мы уже говорили, три ветви брома, разбиваясь, образуют главный центральный модуль внутри куба сурьмы. Каждая ветвь содержит группу из пяти Ану, две группы из четырех Ану и две группы из трех Ану.
В самом центре располагаются три группы из пяти Ану, взятые от каждой ветви. Они самостоятельно занимают место в трех углах тетраэдра. Так как на рисунке нельзя изобразить уникальную идею их движения из-за отсутствия методов, нужно теперь включить воображение для того, чтобы уловить формирование этими же группами пирамиды.
Одна группа занимает позицию наверху, а другая внизу, образуя вертикальную линию. Третья группа вращается вокруг, мнимой вертикальной линии подобно краю диска, который вырезает горизонтально вертикальную линию, рисуя эллипс. Концы вертикальной линии движутся, но очень медленно по сравнению с тем как мчится средняя группа. В целом получается, что верхняя часть находится над нижней, демонстрируя любопытное двойное движение.
Вокруг центральной группы располагаются другие тела. Из них шесть групп по четыре Ану и шесть групп по три Ану. Они размещены следующим образом:
Представьте, что на каждой из шести сторон куба размещаются группы по четыре Ану. Образуется комбинация из шести четверок. Далее представьте второй куб установленный немного наискось в середине первого. На каждой стороне этого куба имеем шесть тел по три Ану. Если вы отчетливо представите эту картину, то будет замечено, что средние точки шести сторон второго куба в действительности образуют средние точки октаэдра. Если мы поместим группы из четырех Ану и группы из трех Ану довольно близко друг к другу в углах октаэдра, мы получаем идею относительно их расположения. Иллюстрация пытается указывать это.
Все триады и кватернеры, как считается, находятся в районе одной большой сферы, которая формирует главный центр молекулы трехбромистой сурьмы. Это и было показано на иллюстрации.
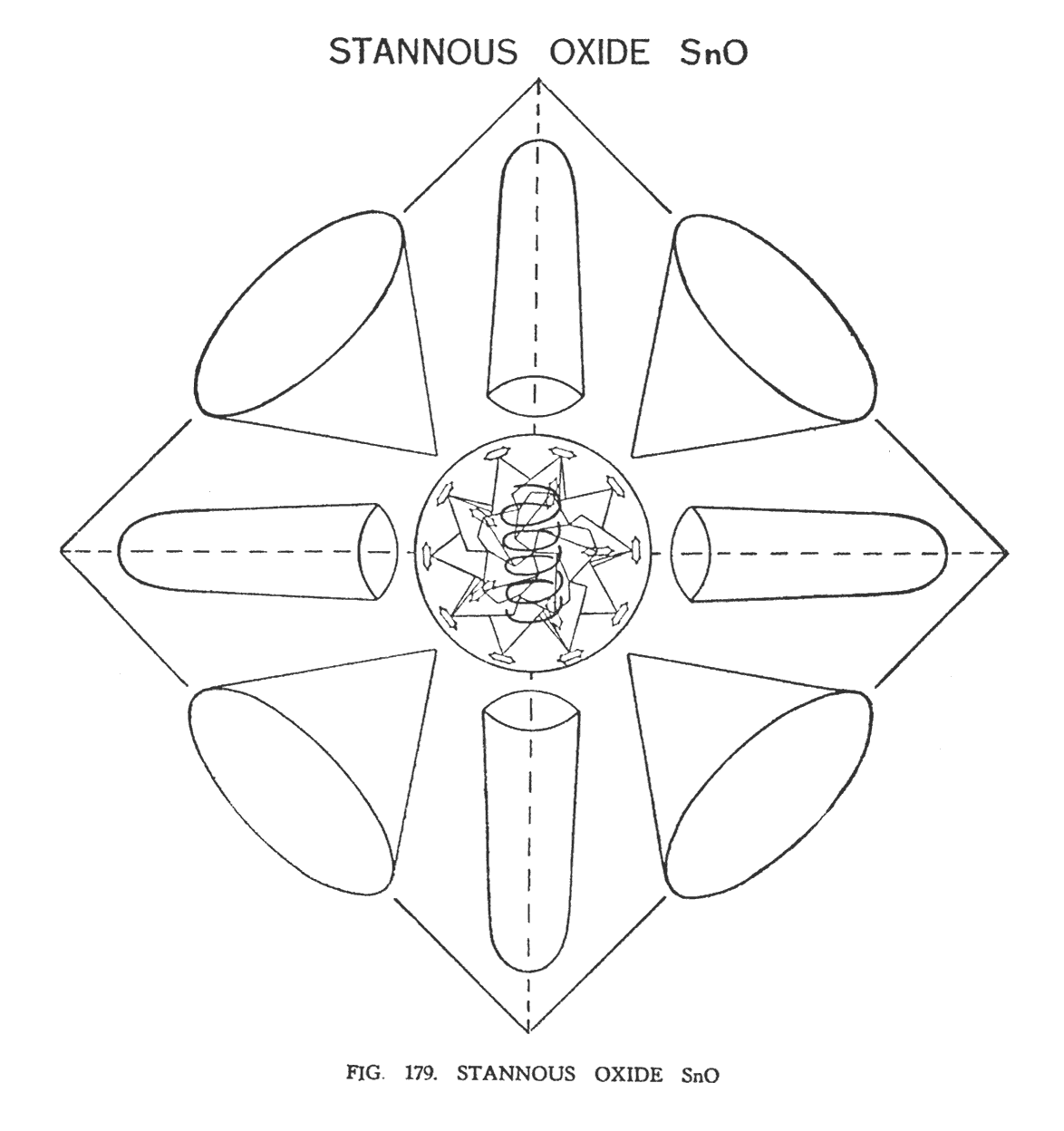
ОКСИД ОЛОВА (SnO)
Олово относится к группе "октаэдры". Атом олова состоит из центрального шара (Ne120), восьми воронок, которые эмитируют каждую сторону октаэдра, и шести шипов, направленных на шесть углов мнимого октаэдра (рис. 179)
В оксиде олова кислород занимает место в середине центральной сферы Ne120. Эта сфера состоит из пяти переплетенных тетраэдров на вершинах которых располагаются ланцетные группы адьярия (Ad6). Центр такого тетраэдрального расположения полон пустот, и кислородная спираль пользуется этим, располагаясь вертикально. Прежде, чем кислород занимает это место, 20 групп Ad6 на некотором расстоянии создают отдельные связи. Атом кислорода управляет этими группами. В результате этого центральная сфера увеличивается, не меняя конфигурации групп. Однако 20 групп адьярия, которые до этого находились горизонтально на вершинах тетраэдров, теперь, развернувшись на 90 градусов, приняли вертикальные позиции, указывая на центр.
Когда в результате нагревания оксида олова кислород удален, атом олова возвращается к нормальным условиям и центральный шар сжимается вновь.
На иллюстрации показано лишь четыре стороны октаэдра. Таким образом, мы видим лишь четыре воронки из восьми и четыре шипа из шести. Четыре воронки и два шипа не видны за боковой гранью. Аналогично и внутренняя сфера не может быть правильно представлена и читатель должен, включив воображение, увидеть 20 ланцетных групп Ad6 в их истинном ракурсе.
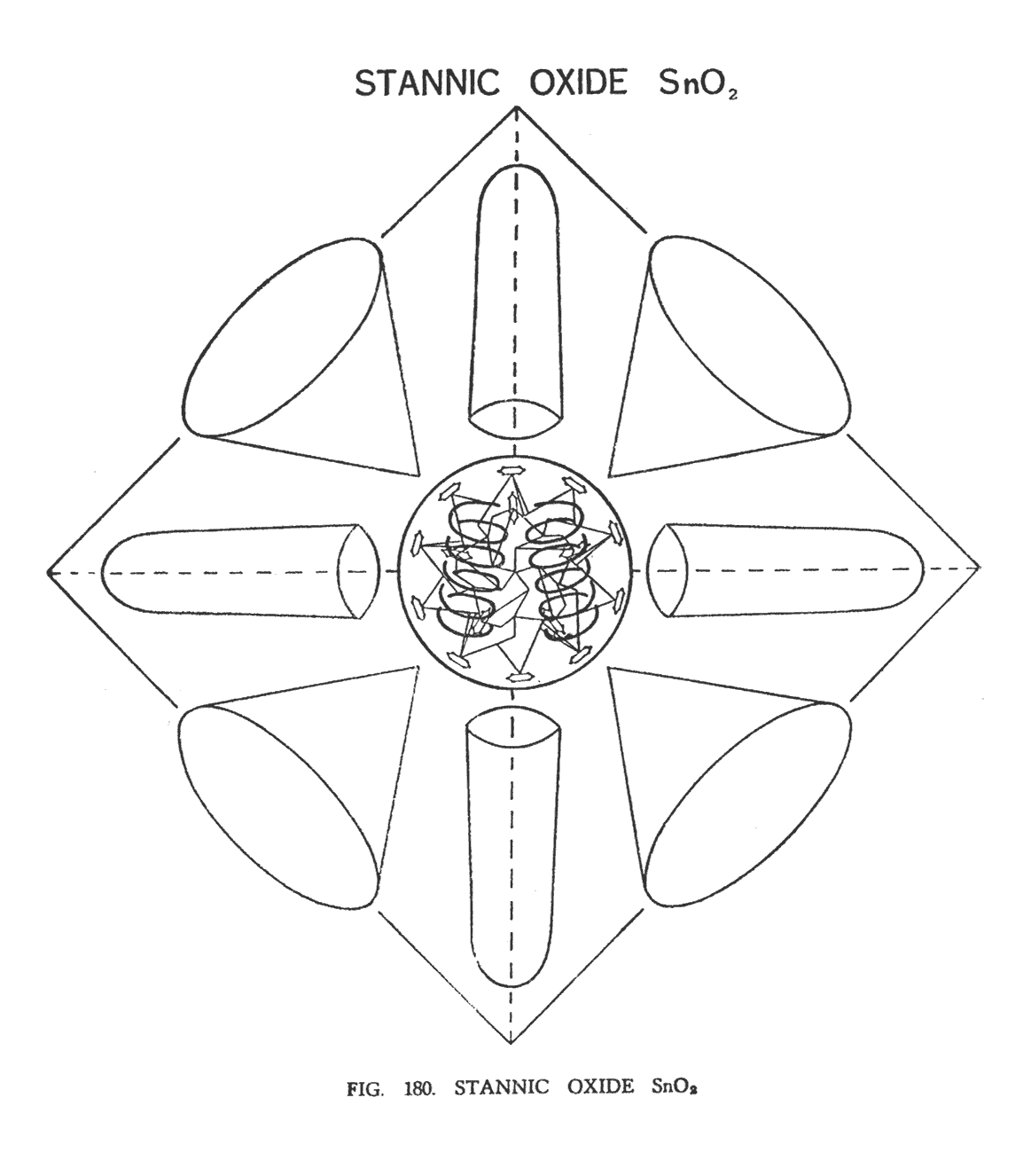
ДИОКСИД ОЛОВА (SnO2)
Как и в оксиде олова (SnO), мы наблюдаем атом олова, который состоит из центрального шара (Ne120), восьми воронок, лежащих на восьми сторонах октаэдра, и шести шипов, указывающих на углы октаэдра.
В SnO2 два атома кислорода находятся внутри центрального шара, которые заполняют предварительно образовавшиеся пустоты. Они расположены вертикально, немного под углом друг к другу (рис. 180) Двадцать групп адьярия (Ad6), расположенные вертикально, как в SnO, сохраняют свое положение, но вместо того чтобы устремляться к центру, они устремлены к двум атомам кислорода. Когда молекула начинает вращаться очень медленно, в результате волевого усилия ясновидящего, сразу становится видно, как происходит взаимодействие между атомами кислорода и близлежащими ланцетными группами. Поскольку атомы кислорода вращаются как вокруг собственной оси, так и вокруг общего центра, самая близкая ланцетная группа, находящаяся в тот момент рядом с кислородом, устремляется к нему, подобно стрелке часов. Как только атом кислорода отходит, она возвращается в прежнее положение, ожидая следующий кислородный атом. Таким образом, ланцетная группа делает любопытное перемещение подобно механизму защелки, двигаясь взад и вперед, поскольку атомы кислорода сменяют друг друга.
Были попытки искусственным путем добавить большее количество атомов кислорода. Но они не увенчались успехом. Как только третий атом кислорода добавлен в систему, и группы Ad6 начинают готовить для него место, вся система тут же распадается.
Четвертый атом кислорода не будет принят вовсе. Искусственно полученная молекула SnО4, очень непостоянна и существует только до тех пор пока волевое усилие оператора сконцентрировано на этом. Как только усилие остановлено, тут же формируется диоксид олова, вытесняя лишние атомы, которые вступают в реакцию с атомами водорода, образуя 2H2O.
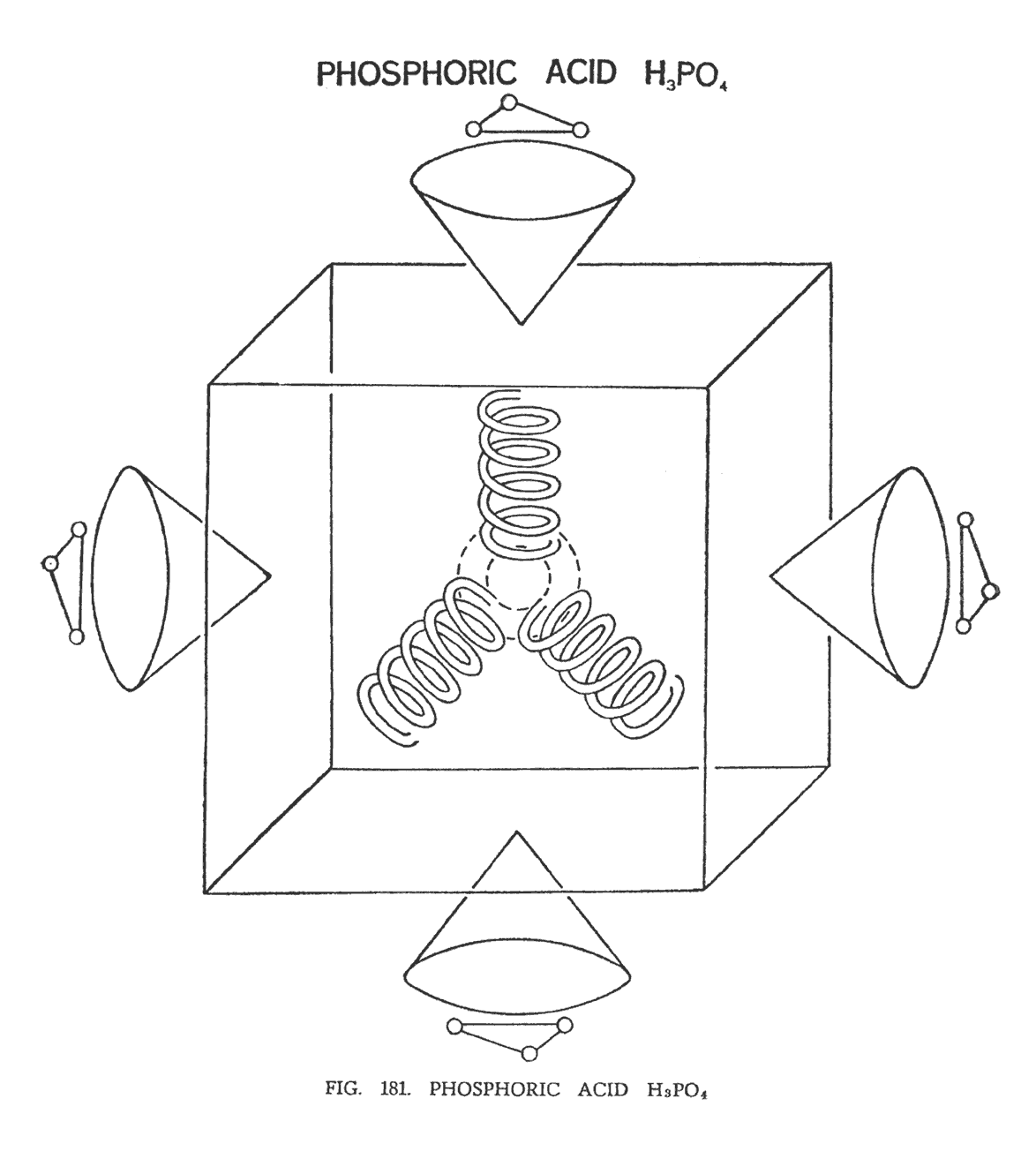
ФОСФОРНАЯ КИСЛОТА (H3PO4)
Группа фосфата (РО4) состоит из одного атома фосфора и четырех атомов кислорода. Хотя фосфор относится к группе "кубы", модель, на базе которой была построена серная кислота (Н2SO4), остается неизменной см. (рис. 174) . Иллюстрация показывает четыре атома кислорода, направленные к сторонам тетраэдра, на концах которых расположены четыре воронки серы с компонентами водорода, плавающими над ними.
В нашем случае мы также имеем четыре атома кислорода, расположенные в центре молекулы. Заметьте, что тетраэдральное расположение кислорода осталось неизменным. Он движется намного быстрее воронок фосфора, которые разместились вокруг него, эмитируя куб.
В фосфорной кислоте (H3PO4), как и в серной, атомы водорода разбиваются на треугольники, размещаясь над каждой воронкой (рис. 181) .
Имеются различные виды фосфорных кислот. В основном они похожи своей структурой. Например, H3PO8, подобна H3PO4 за исключением того, что атомы кислорода расположены в трехмерном треугольнике внутри куба.
Также было обнаружено, что имеется другая модификация фосфорной кислоты, в которой воронки фактически разбиваются. Каждая воронка фосфора содержит по два колоколовидных тела, которые, освобождаясь, самостоятельно группируются по три, располагаясь над четырьмя атомами кислорода. Атомы водорода ведут себя, как и прежде, размещаясь над ними.
Еще одна модификация фосфорной кислоты, наблюдаемая исследователями, имела всего два атома водорода. В этом случае они разбивались как на высшем подплане, располагая свои компоненты над шестью воронками.
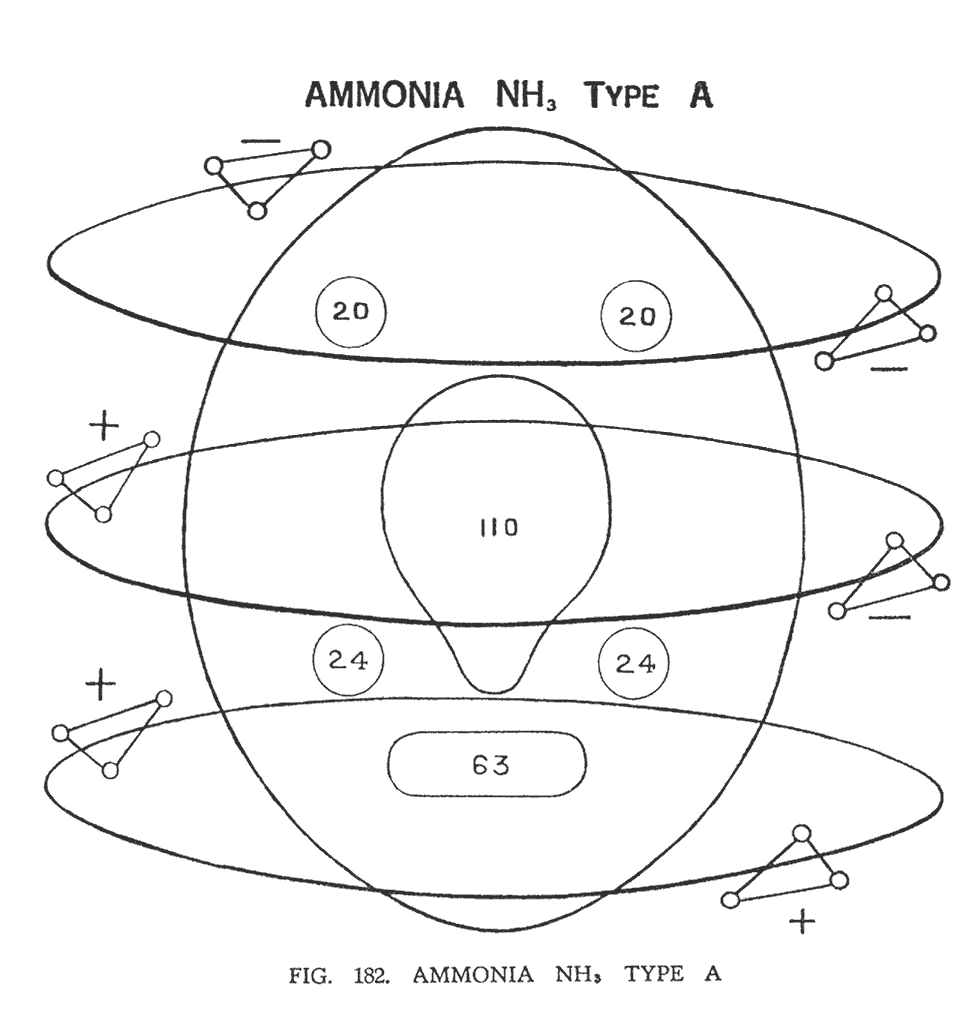
АММИАК (NH3), ВИД А
В аммиаке химический атом азота сохраняет свою целостность, располагаясь в центре молекулы, в то время как атомы водорода, разбиваясь на шесть треугольников, вращаются вокруг него как планеты вокруг солнца (рис. 182) Таким образом, возникают три орбиты, по которым, разбившись на пары, движутся треугольники водорода. Но полярность пар, как следовало бы ожидать, не везде одинакова. На первой орбите, самой верхней, оба треугольника имеют отрицательную полярность. На второй, средней, как и должно быть — положительную и отрицательную. На третьей, самой нижней, — положительную полярность.
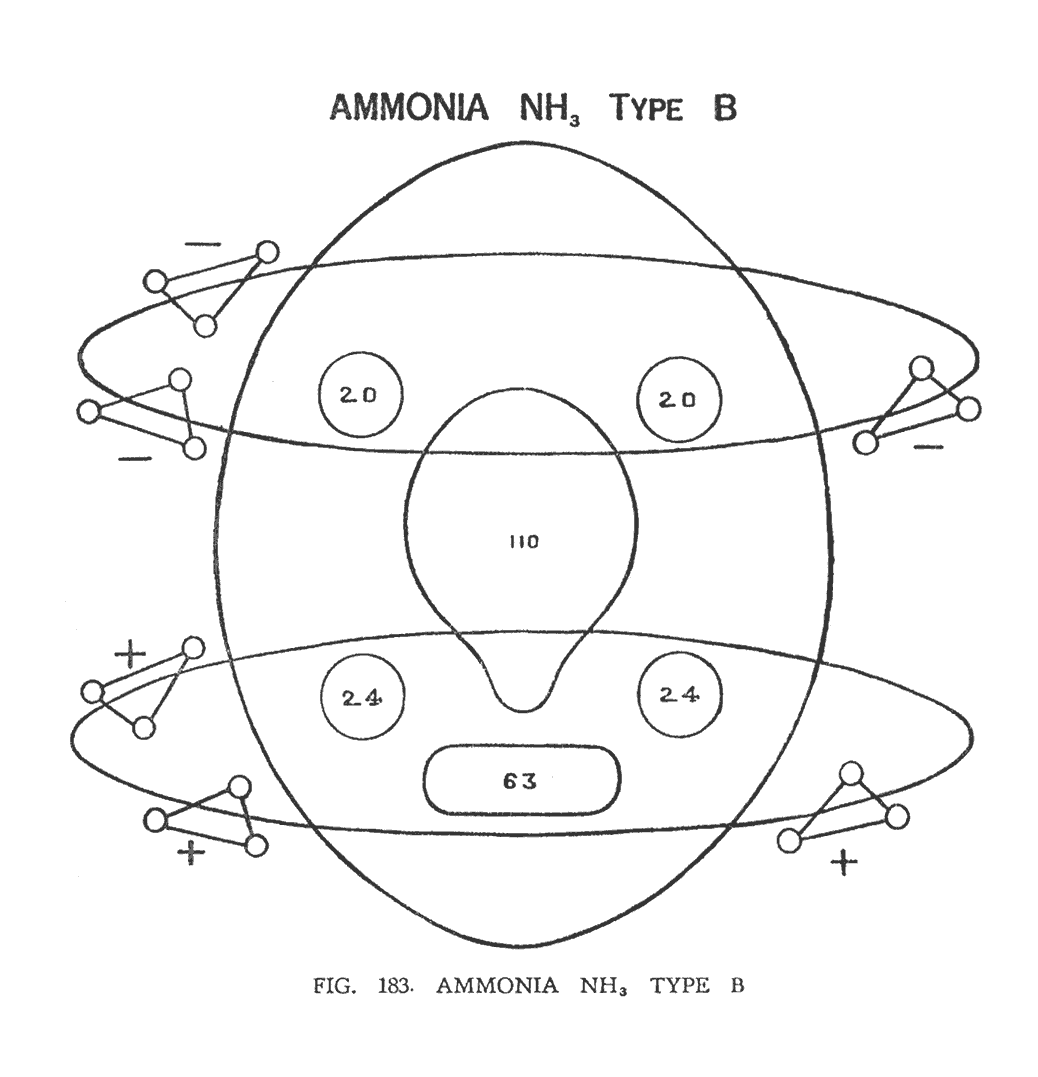
АММИАК (NH3), ВИД В
В этой модификации (рис. 183) химический атом азота также сохраняет свою целостность, но треугольники водорода уже движутся не по трем орбитам, а по двум. По первой орбите вращаются три отрицательных треугольника, по второй — три положительных.
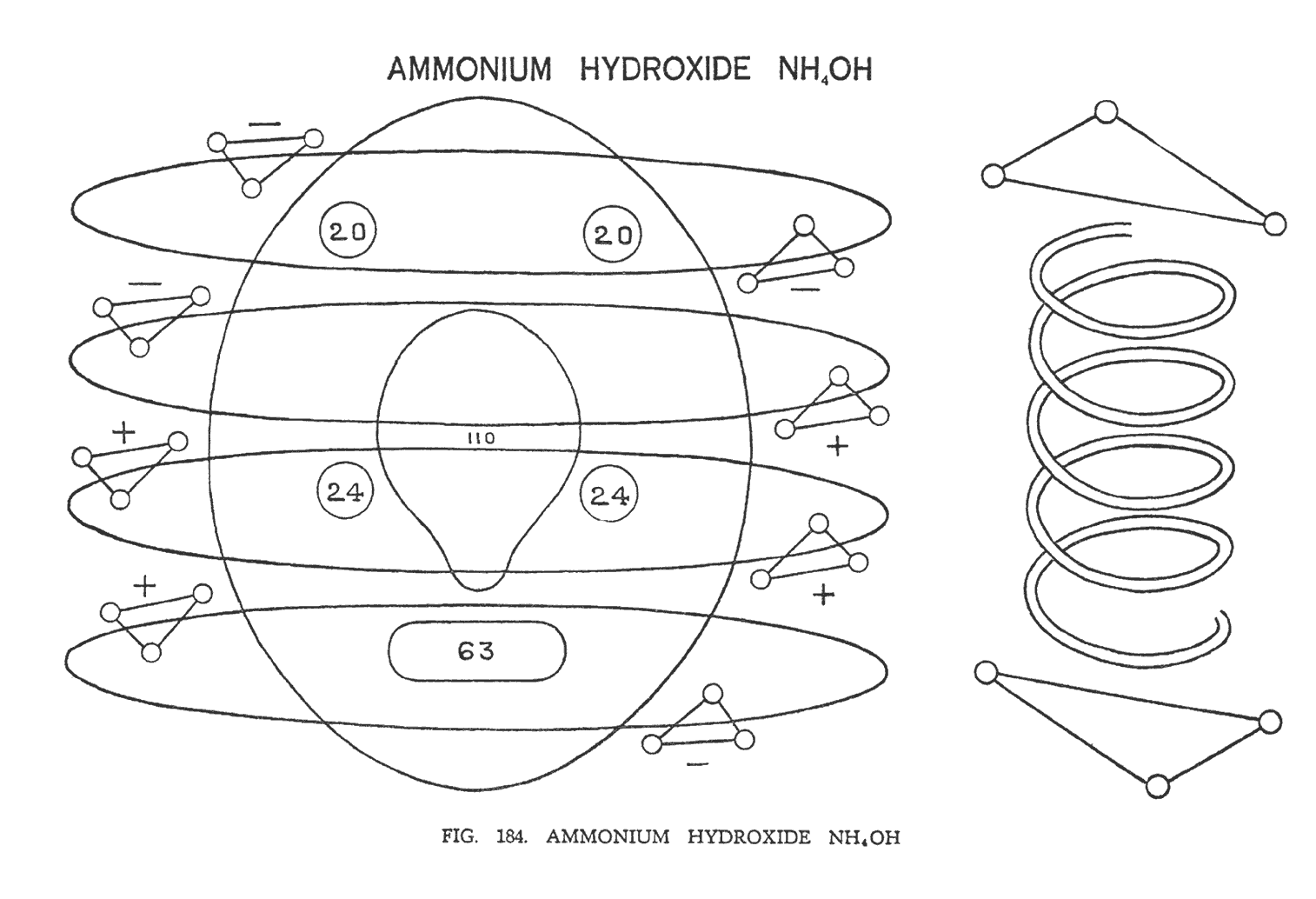
ГИДРОКСИД АММОНИЯ (NH4OH)
Группа аммония (NH4) выстраивается по прототипу аммиака. Однако мы имеем четыре орбиты вместо трех. На первой орбите — два отрицательных треугольника, на второй — положительный и отрицательный, на третьей — два положительных и на четвертой — положительный и отрицательный (рис. 184) Рядом с аммонием выстраивается гидроксильная группа (ОН).
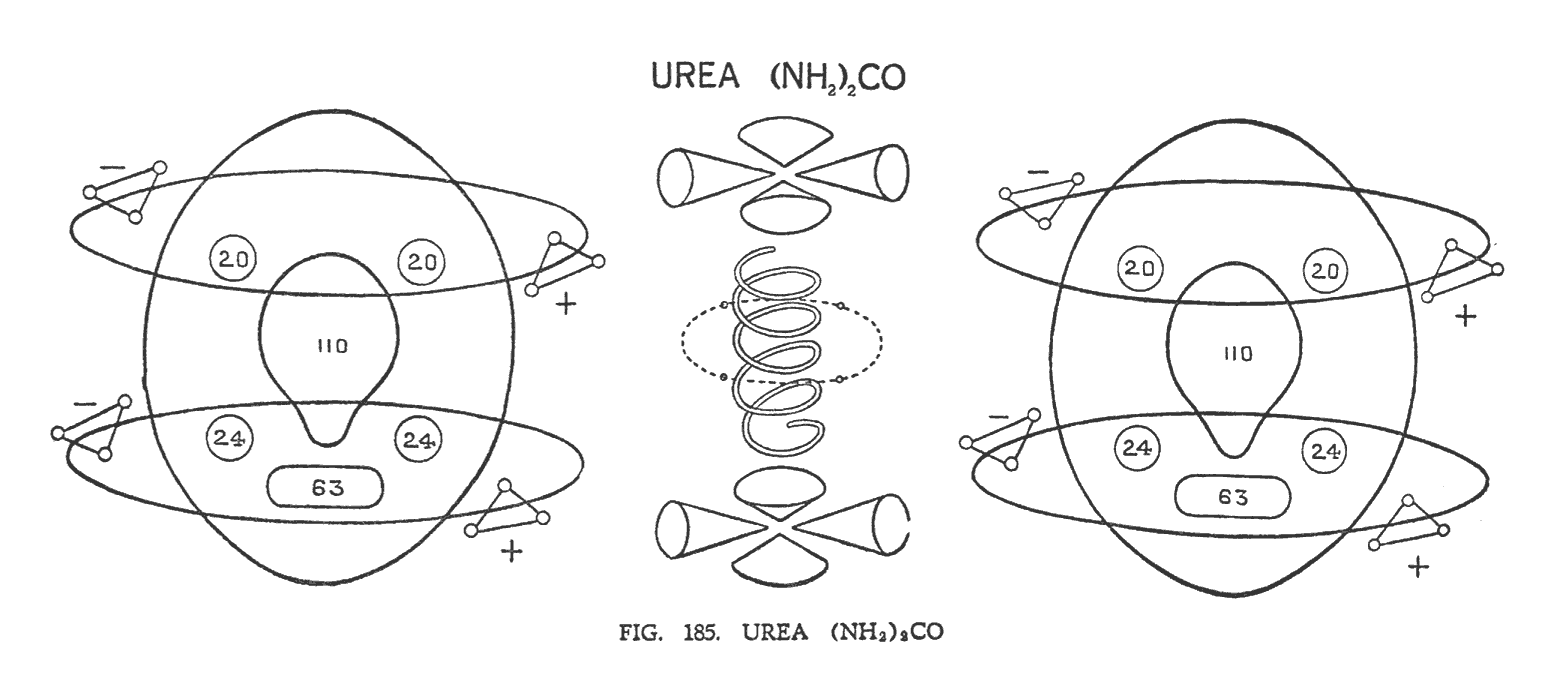
МОЧЕВИНА ((NH2)2CO)
В молекуле мочевины (рис. 185) мы снова встречаем модули азота с водородными компонентами. Только вместо трех орбит они имеют лишь две. Треугольники водорода как и полагается на каждой орбите разнополярны. Модули азота вращаются вокруг третьего модуля — окиси углерода (СО). Напомним, что спираль кислорода располагается в центре молекулы. Вокруг нее вращаются четыре отделившиеся соединительных Ану углерода. Воронки углерода, группируясь по четыре, располагаются над и под кислородной спиралью.
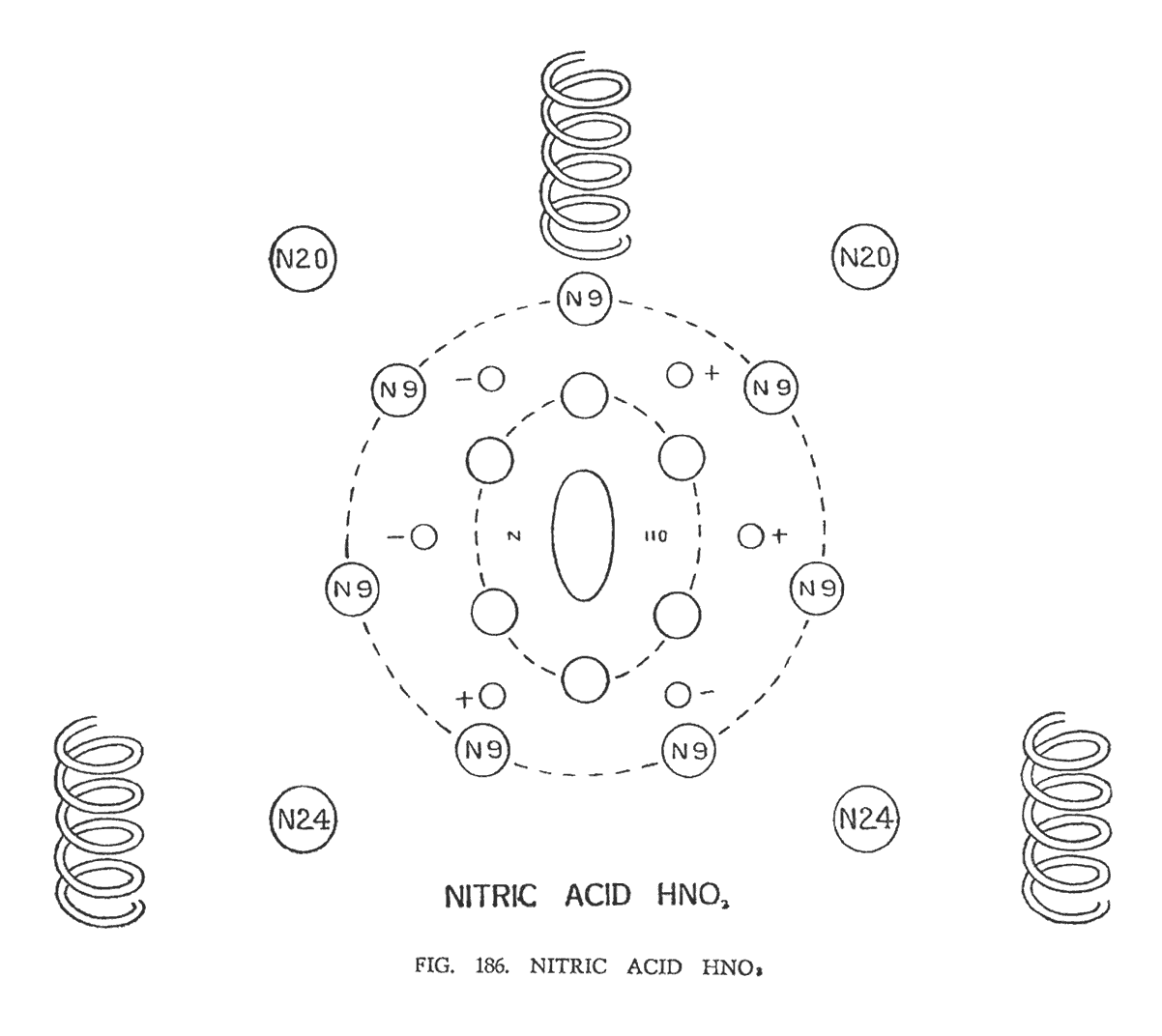
АЗОТНАЯ КИСЛОТА (HNO3)
В азотной кислоте мы наблюдаем три спирали кислорода, которые движутся вокруг атома азота, потерпевшего значительное дробление (рис. 186)
Центральную часть молекулы сформировала известная нам группа N110. Эллипсоид, который находится в центре группы, занимает вертикальную позицию. Вокруг него расположились шесть сфероидов (N14), которые самостоятельно разместились в главных точках шестиугольника. Вокруг шестиугольника курсируют шесть групп — компоненты водорода, находящиеся в гексагональной зависимости, которые на иллюстрации отмечены "+" и "_". Вокруг водорода вальсируют семь сфероидов N9, формирующие группу N63 в азоте. Они размещены в главных точках семиугольника. Оставшиеся четыре группы азота (2N20 и 2N24), отдалившись от центрального модуля, подобно страже находятся в четырех углах квадрата.
Три атома кислорода лежащие в трех главных точках треугольника, вращаясь, прибывают в трехмерном измерении, образуя прямой угол относительно горизонта.
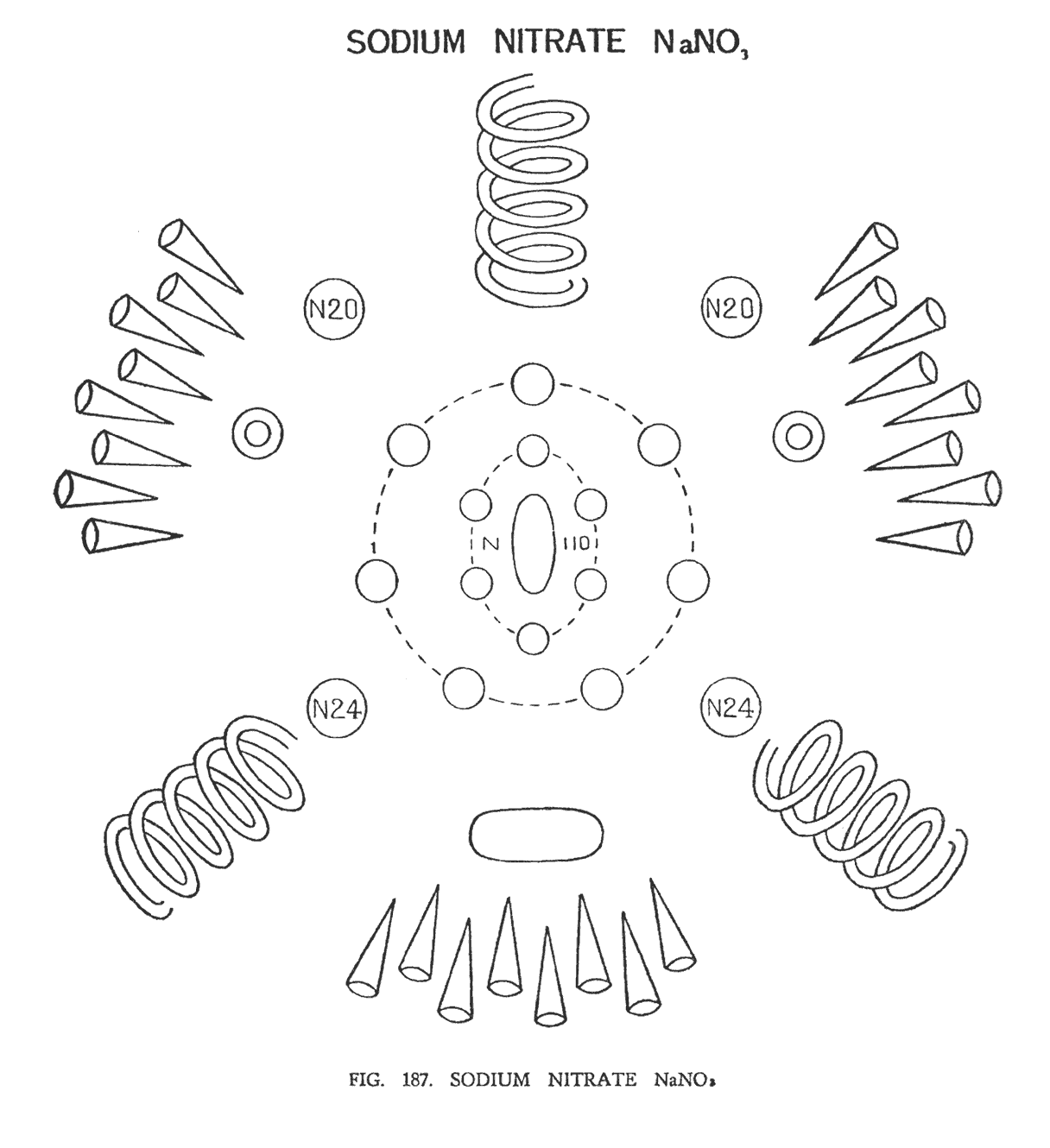
НИТРАТ НАТРИЯ ИЛИ ЧИЛИЙСКАЯ СЕЛИТРА (NaNO3)
Нитрат натрия своей структурой напоминает HNO3 и KNO3 (рис. 187) Каждый из них имеет стабильную группу NO3. Натрий, который относится к группе "гири", формирует вокруг этой группы свои уникальные связи. Натрий состоит из центральной перемычки (Na 14) и двух сфер (Na 10), от которых, подобно цветку, отходят 12 воронок. Таким образом, в сумме имеем 24 воронки.
Атом азота, как и в других нитратах, формирует центральную группу N110, группу N63 вокруг нее и четыре группы-сферы — 2N20 и 2N24, лежащие в углах квадрата. Три атома кислорода не изменяют своего положения, образуя пространственный треугольник.
Группы, которые остались не рассмотрены, некогда формировали структуру натрия. Теперь они очень разбросаны, и узнать в них атом натрия достаточно сложно. Воронки больше не образуют лепестки цветка, а скорее напоминают кисти, размещенные в трех группах по восемь, располагаясь между кислородом. Na 10, от которого отходят воронки расположен рядом. Больший эллипсоид — Na 14, расположен ниже группы N110. Все группы движутся в одном и том же направлении.
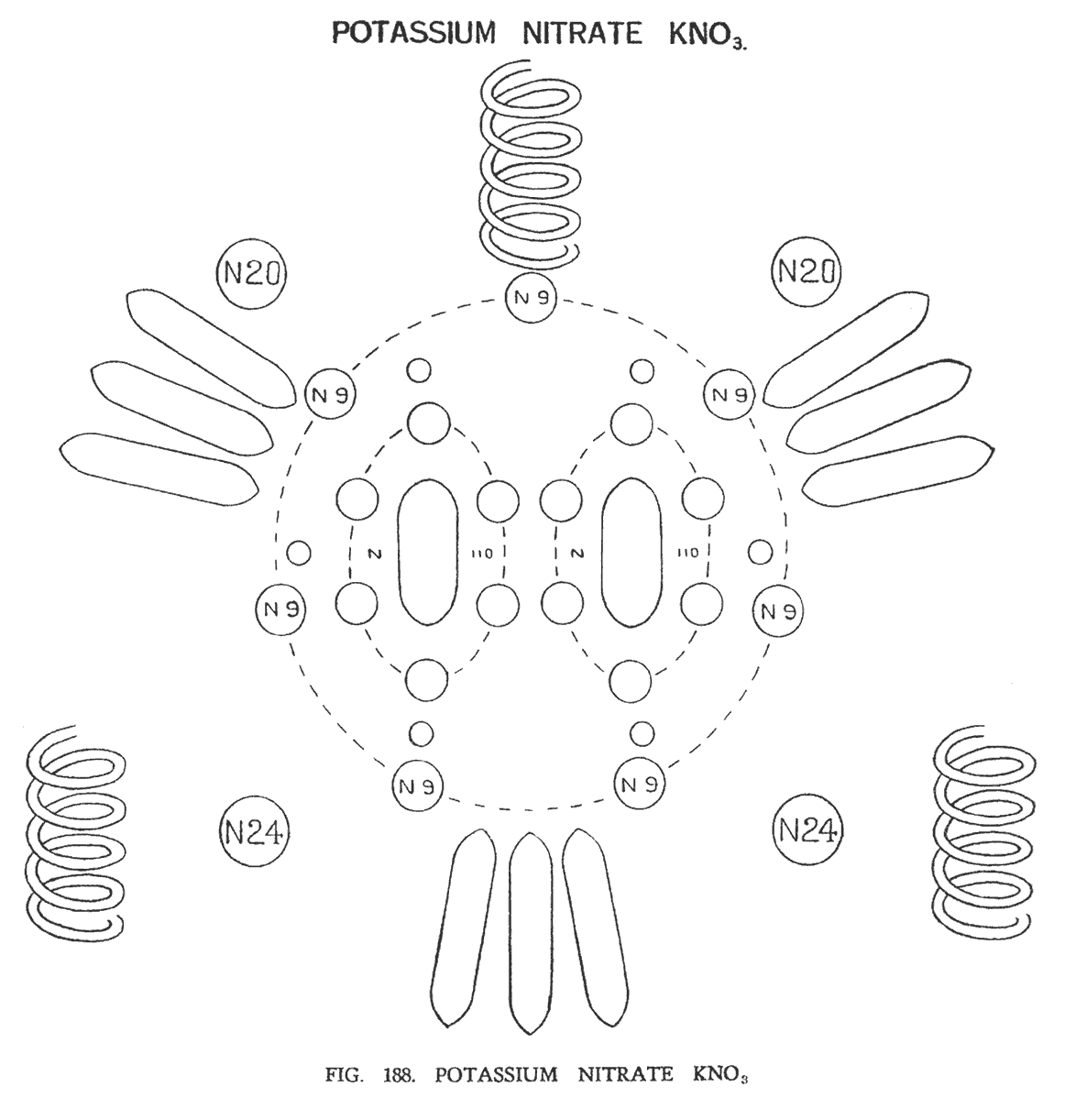
НИТРАТ КАЛИЯ ИЛИ ИНДИЙСКАЯ СЕЛИТРА (KNO3)
Теперь вместо натрия мы имеем химический атом калия в соединении с группой (NO3). Калий имеет девять шипов лития (9Li63), шесть маленьких сфер (6Li4) и один центральный шар N 110. Атом калия, так же как и атом азота расщепляется. Атом кислорода, обретая огромную активность, действует как агент, вызывающий это расщепление (рис. 188)
Если бы мы могли вписать элементы этой молекулы в тетраэдр, то частично смогли бы объяснить путь, по которому молекула была построена. Но в этой молекуле стороны тетраэдра не упорядочены, и поэтому нам трудно объяснить перспективу.
Вначале появляются две группы N110, непрерывно вращающиеся вокруг общего центра. Затем двенадцать групп Li 4, образуя в пространстве шестиугольники, окружают их, подобно тому, как это происходило в водородном модуле HNO3. Вокруг образовавшихся модулей выстраивается кольцо из семи групп N9, пришедшие от группы N63. Четыре сферы 2N20 и 2N24, как и прежде занимают свои позиции в углах квадрата.
Девять шипов калия (9 Li63), размещаясь между атомами кислорода, образуют группы по три. Иллюстрация дает предположительную оценку характера их размещения, так как точно это не установлено. Возможно, в трехмерном пространстве эти группы могут выстроиться по-другому. Атомы кислорода не меняют своего расположения и сохраняют позиции, занятые в молекуле HNO3.
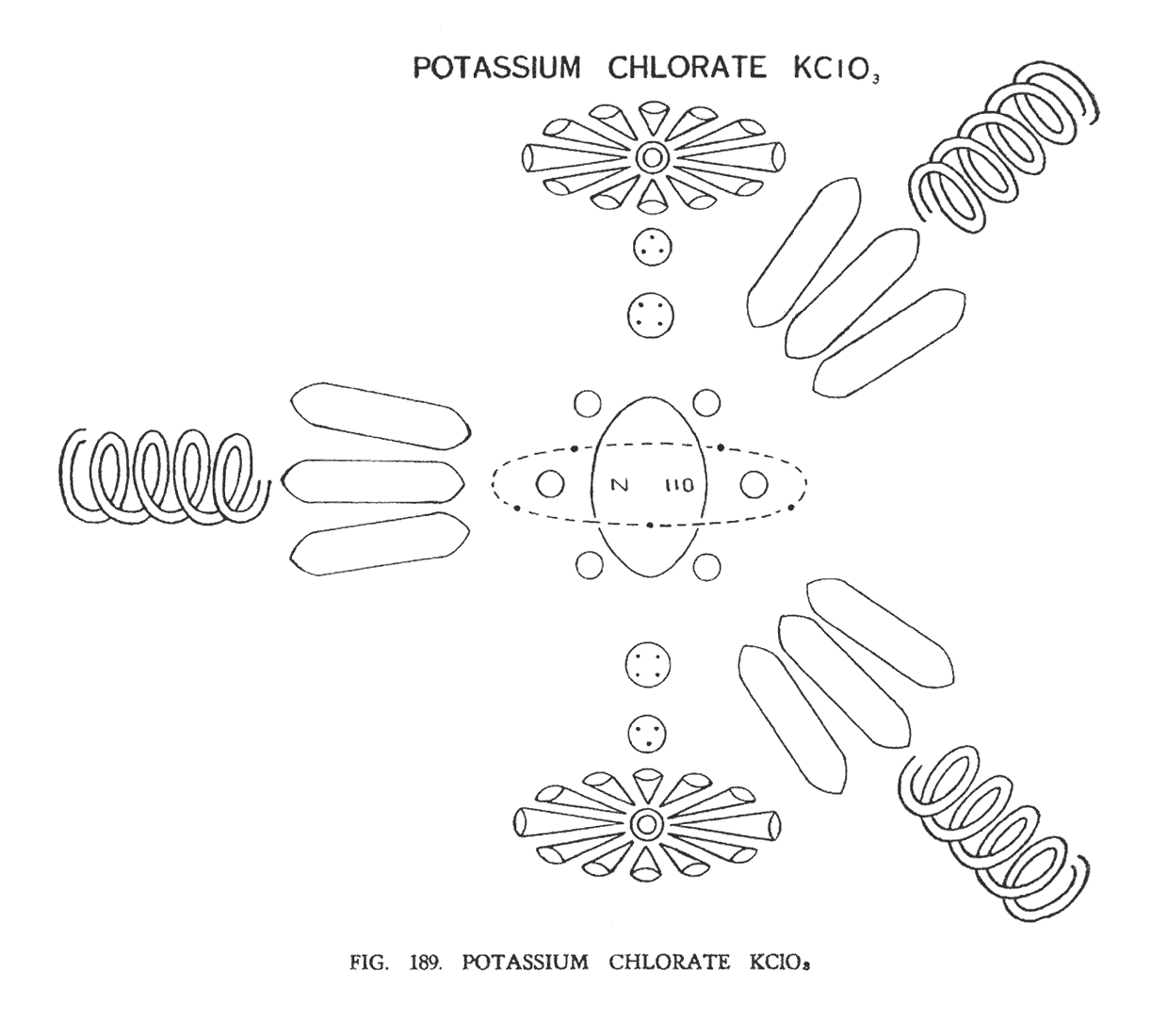
ХЛОРАТ КАЛИЯ (KClO3)
Структура этой молекулы (рис. 189) несколько напоминает структуру молекулы нитрата калия. Калий — элемент группы "шипы". Он состоит из центрального шара (N 110), окруженного шестью сферами (Li 4). Выше них лежат девять шипов группы Li63.
Атом хлора относится к группе "гири". Он состоит из соединительной перемычки (Cl 19) и двух шаров на ее концах. Вокруг каждого шара, подобно лепесткам цветка отходят двенадцать воронок.
Атомы кислорода, как и обычно, прибывают в форме спирали.
Элементы молекулы хлората калия, выстраиваясь надлежащим образом, демонстрируют нам уже известную форму гирь. Вокруг центральной перемычки разместились атомы кислорода, заняв свое место в главных точках равнобедренного треугольника. Располагаясь в пространстве, они, вероятно, лежат под прямым углом относительно плоскости, также как в азотной кислоте и нитрате калия.
Главный центр молекулы — группа N110, которая лежит в центре перемычки — соединительной ветви. Вокруг нее расположились шесть групп Li 4. Эти группы, принадлежащие калию, теперь дополняют соединительную ветвь. Центральная сфера соединительной перемычки, содержащая пять Ану, освобождает заключенные частички, которые образуют циркулирующее кольцо вокруг группы N110. Оставшиеся четыре сферы, от таким образом расширившейся соединительной ветви, завершают ее формирование. Воронки хлора, как и полагается, увенчивают верхнюю и нижнюю части ветви.
Девять шипов атома калия, располагаясь под кислородом в углах равнобедренного треугольника, завершают эту композицию.
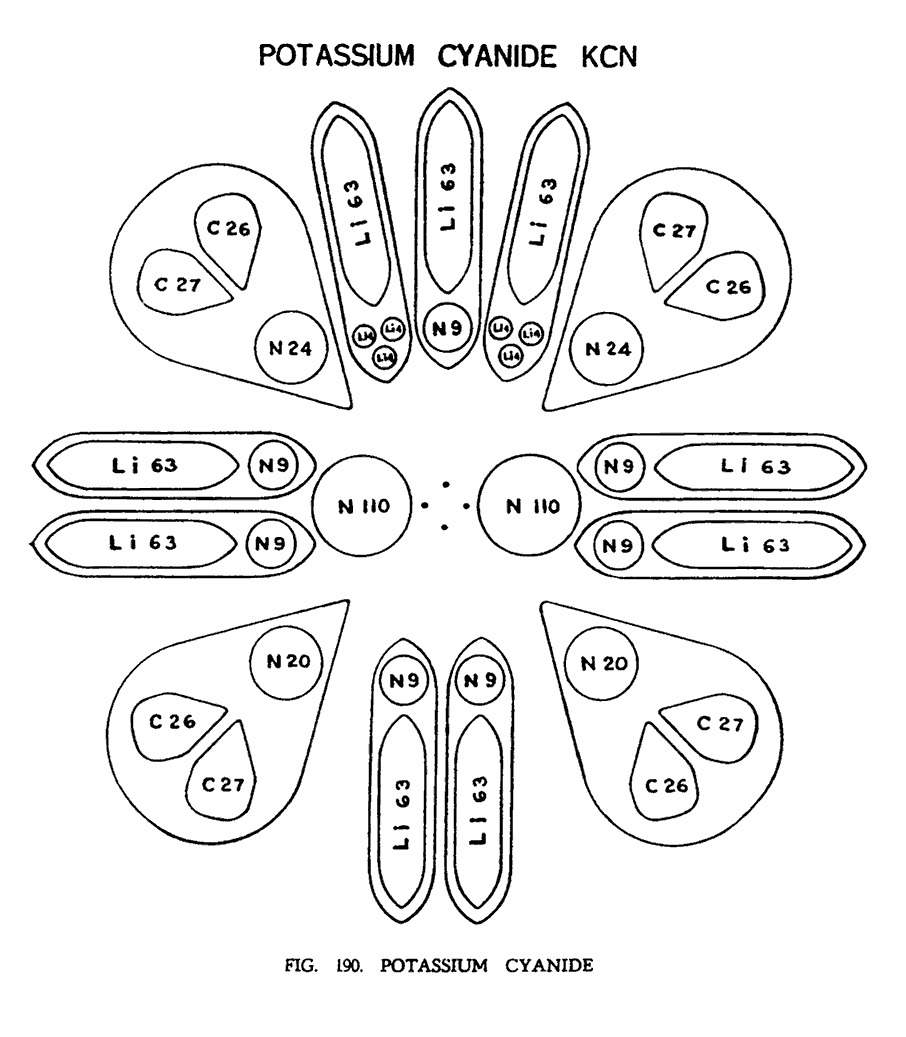
ЦИАНИД КАЛИЯ (KCN)
Этот состав был исследован Ледбитером в 1922. Следующая цитата, извлеченная из его записей, которая была написана 9-того сентября 1922, иллюстрирует путь, которым он приближался к этой работе и терпению, с которым он повторил свои наблюдения, чтобы быть совершенно уверенным относительно приведенных фактов. KCN — довольно сложная молекула, и все ее составляющие части должны быть систематизированы и качественно исследованы.
"Я провел несколько часов, исследуя KCN, терпеливо выполняя кропотливую работу. Слой за слоем, воздействуя на комбинации составляющих частиц, разъединяя их группы, я наблюдал обратный процесс, улавливая особенности их соединения. Через некоторое время мне удалось, наконец, сделать кое какие выводы.
То, что изображено на иллюстрации (рис. 190) — это очень грубая модель того, что мне удалось увидеть. Двухмерное изображение конечно же не в состоянии адекватно выразить идею того, что в действительности происходит в трех и четырехмерном измерении. Но иллюстрация может дать идею тех процессов, которые протекают в составе, а интуиция и развитое воображение помогут читателю нарисовать реальную картину происходящего.
Молекула не симметрична, но она имеет ярко выраженную тенденцию к этому. Группа из трех областей стремится к симметрии, так что с небольшой погрешностью можно разделить молекулу на верхнюю и нижнюю части. Фактический центр состоит из четырех соединительных атомов углерода, покинувших свои воронки. Рядом с ними мы наблюдаем два "воздушных шара" азота которые очень резво вращаются вокруг центра. Создается впечатление, что они настолько увлечены своей работой, что не имеют никаких связей с другими группами, которые их окружают и которые вращаются гораздо медленнее предыдущих.
Каждая группа казалось до некоторой степени превратилась в автономный модуль, вращающийся вокруг собственной оси под прямым углом к общей схеме. Подобно карандашу, прокрученному между большим указательным и средним пальцами, который острием при этом неумолимо указывает на активный центр. Казалось, что каждый шип калия и каждая пара воронок углерода аннексируют одно из меньших тел азота, и напрочь отказываются от них отделяться".
Из рисунка видно, что главный центр молекулы сформирован из четырех соединительных Ану углерода, о которых упоминает г. Ледбитер.
Четыре группы воронок, отделившиеся от атома углерода, расположены парами, как показано на иллюстрации. Каждая пара воронок удерживает группу азота N24 или N20. Очевидно, они действительно помещены в углы тетраэдра, для демонстрации трехмерной формы как предложил г. Ледбитер.
Оставшиеся семь групп (N 9) от большого модуля азота N63, нашли свое место, присоединившись к шипам калия — Li63.
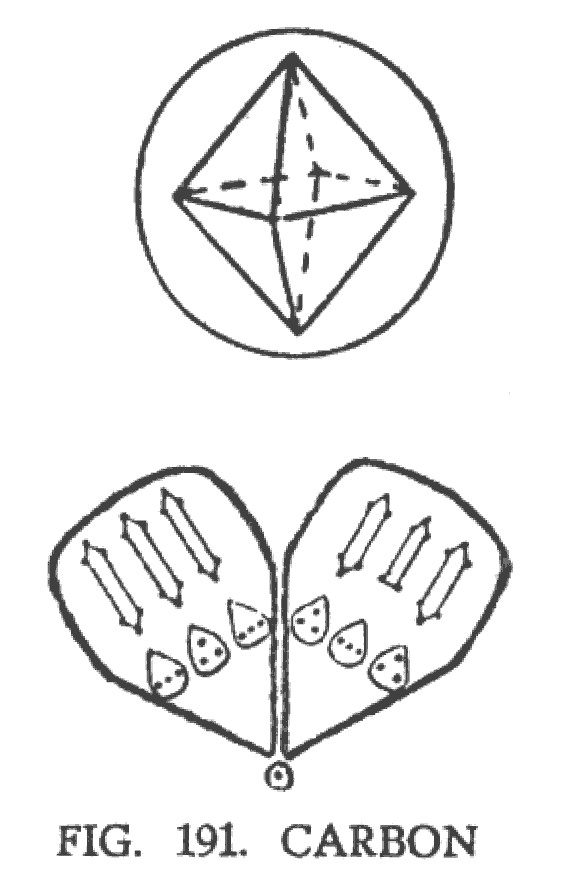
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Углерод — типичный октаэдр, составленный из восьми воронок. Четыре из них положительны и четыре отрицательны (рис. 191). Воронки расположены парами. Каждую пару объединяет соединительный Ану. Химики пытались четырехвалентный углерод схематически представить так:
|
|
— - — С — - —
|
|
Они предположили, что структура углерода — тетраэдральна и состоит из центра и четырех воронок, направленных к сторонам тетраэдра. Однако никакой химик пока не предположил, что углерод имеет структуру октаэдра, которая была обнаружена в результате ясновидения.
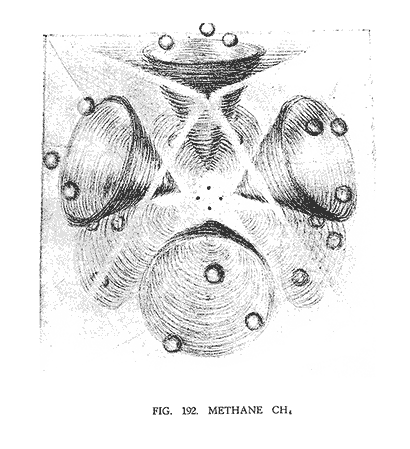
МЕТАН (CH4)
Метан — самый простой элемент из углеродистых соединений, цепной ряд которого составлен из одного атома углерода и четырех атомов водорода.
На (рис. 192) показано, что получается в результате взаимодействия этих элементов. Четыре атома водорода разбиваются на восемь групп, имеющих треугольную зависимость. Четыре группы положительны и четыре отрицательны. Каждая положительная группа водорода прибывает в раструбе отрицательной воронки углерода, а каждая отрицательная группа водорода находится в раструбе положительной воронки углерода.
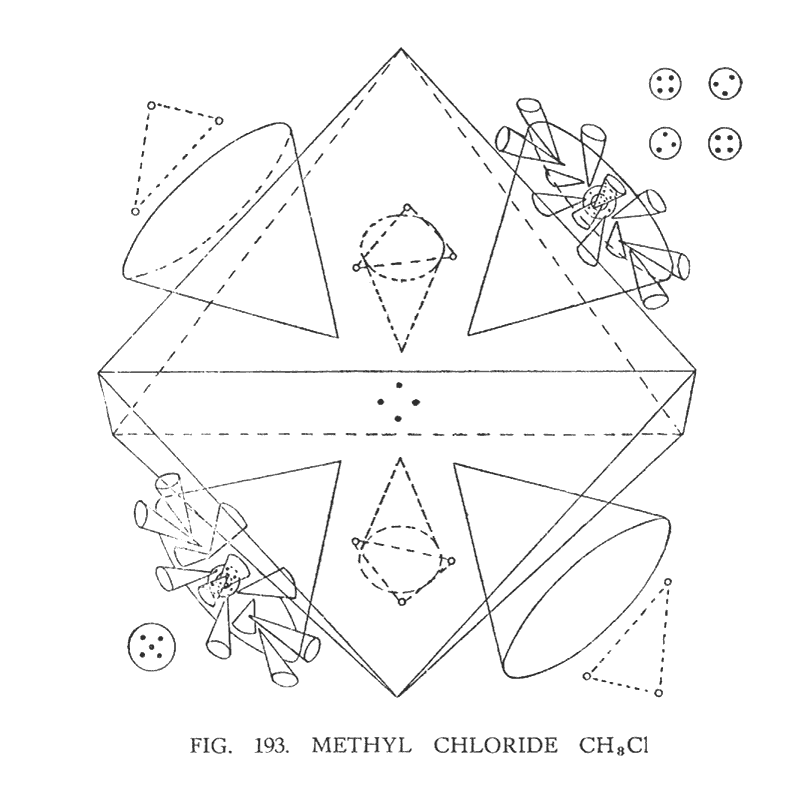
МЕТИЛ ХЛОРИД (CH3Cl)
Первая группа углеродистых соединений, составленная из цепного ряда метана, CH4 была показана на рис. 192. Метан можно представить так:
Н
|
|
Н — - — С — - — Н
|
|
Н
Метил хлорид можно структурно изобразить, заменяя атом водорода, на атом хлора:
Н
|
|
Н — - — С — - — Cl
|
|
Н
Хлор, который относится к группе "гири", подвергается разрушению. Два центральных шара, которые удерживают по двенадцать воронок, отделяются от соединительной перемычки. Сама перемычка также разбивается на составляющие компоненты. Результат этого иллюстрирует (рис. 193)
Как было упомянуто ранее, в центре ветви натрия находится группа, состоящая из шести Ану. Она положительна и, появившись, действует как центр целого атома. Аналогично натрию, в хлоре так же имеется подобный центр, но он состоит не из шести, а из пяти Ану. Когда атом хлора разбивается, этот центр, захватывая один центральный шар с воронками, направляется к отрицательной воронке углерода и, привлеченный магнетизмом воронки, становится ее спутником. Оставшиеся элементы центральной ветви хлора увлекают за собой второй центральный шар с двенадцатью воронками, направляясь к положительной воронке углерода и также, привлеченные ее полем, становятся спутниками воронки. Над шестью оставшимися воронками углерода курсируют треугольники водорода подобно тому, как мы это наблюдали в метане.
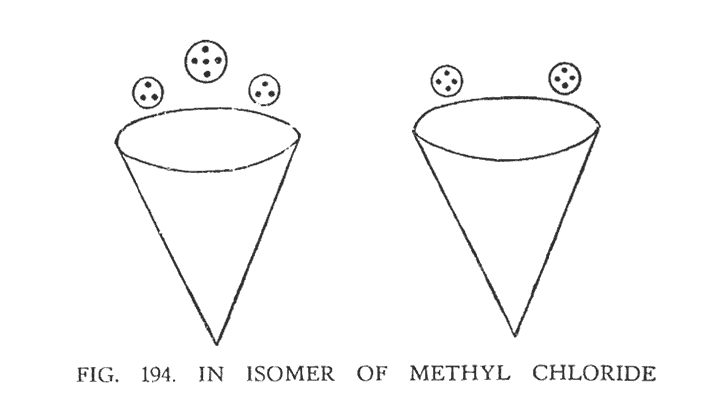
ИЗОМЕР МЕТИЛА ХЛОРИДА (CH3Cl)
Наблюдая метил хлорид, мы обнаружили некоторые особенности его соединения в различных группах. Эти особенности наблюдались в селективности центральной сферы соединительной перемычки хлора. Наглядно это иллюстрирует (рис. 194) Над раструбами двух воронок углерода мы наблюдаем теперь другую комбинацию групп.
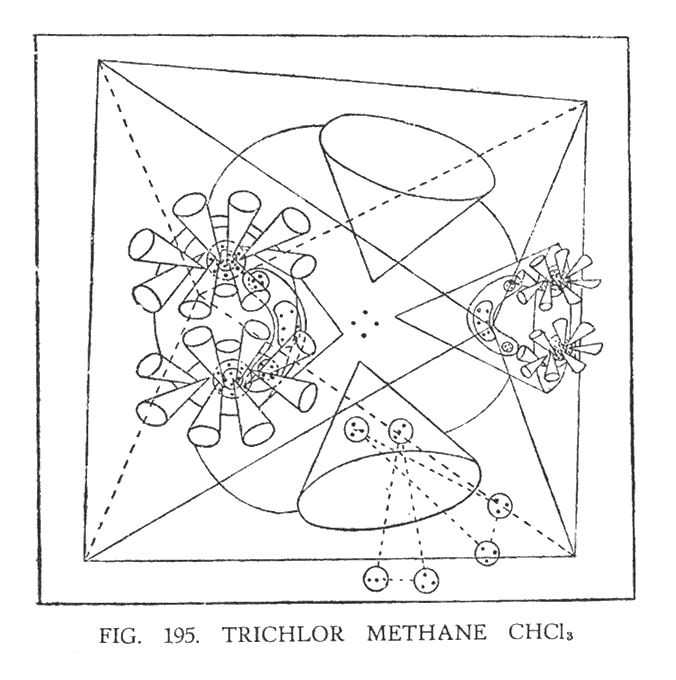
ТРИХЛОР МЕТАН (CHCl3)
Исследуя этот состав, ясновидящий может схематически изобразить его следующим образом (рис. 195)
В предыдущей комбинации (CH3Cl), наблюдая за атомом хлора, мы обнаружили, что он находится в чрезвычайно раздробленном состоянии. В трихлор метане, однако, атом хлора не так разбит, но часть его поглощена воронками углерода. Создается впечатление, что хлор, поддавшись циркулирующему потоку воронок углерода, частично оказался поглощен ими. В результате этого, соединительная перемычка хлора значительно деформировалась, приобретая подковообразную форму, но воронки вместе с центральным шаром остались на поверхности. Часть атома водорода также оказалась в раструбе воронки.
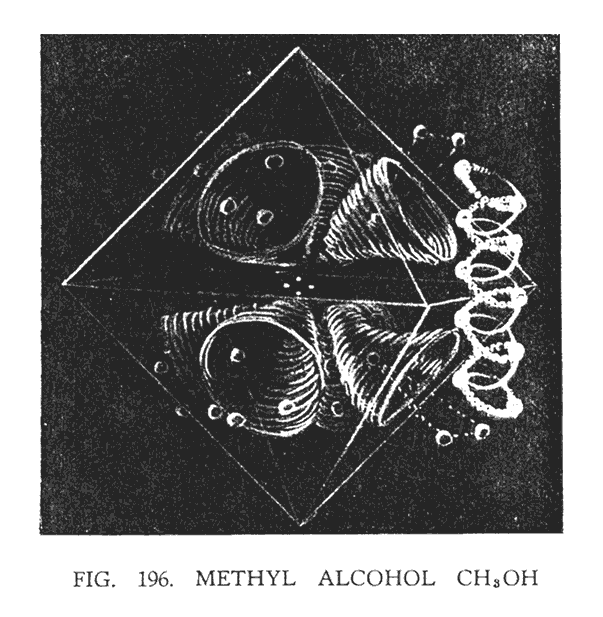
4. МЕТИЛОВЫЙ СПИРТ (CH3OH)
Метиловый спирт отличается от метана отсутствием одного атома водорода, который заменен гидроксильной группой (ОН). Таким образом, имеем структурную формулу:
Н
|
|
H — - - С — - -OH
|
|
Н
Гидроксильную группу (ОН) мы уже исследовали, рассматривая рис. 158. (Pис. 196) демонстрирует ее связь с углеродом и тремя атомами водорода. Гидроксильная группа располагается вертикально относительно атома углерода. Верхние треугольники водорода оказываются частично поглощенные мощными вихрями воронок углерода.
В ходе исследований было отмечено, что кислород обладает повышенной степенью единства и практически ни в одной комбинации не разбивается для того, чтобы приспособиться к другим атомам. В представленном рисунке, исследователь описал поведение кислорода своеобразным жаргоном, назвав его "жесткий как кочерга".
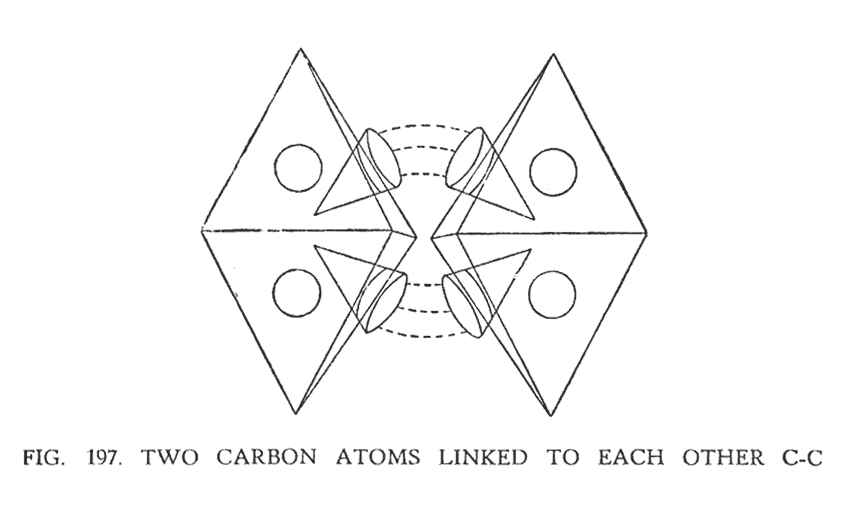
5. ЭТИЛОВЫЙ СПИРТ (C2H5OH)
В этой молекуле мы наблюдаем два атома углерода, связанные одной цепочкой. (рис. 197). демонстрирует эту связь. Положительная воронка одного атома углерода устремляется к отрицательной воронке другого атома углерода, образуя неразрывную цепь. Связанные воронки не могут, конечно же, находиться на одном плане и, следовательно, результирующая действующих сил, имеет изогнутый вектор.
Этиловый спирт можно изобразить структурно следующим образом:
Исследуя (рис. 196) и (рис. 197). можно сопоставить полную картину структуры молекулы.
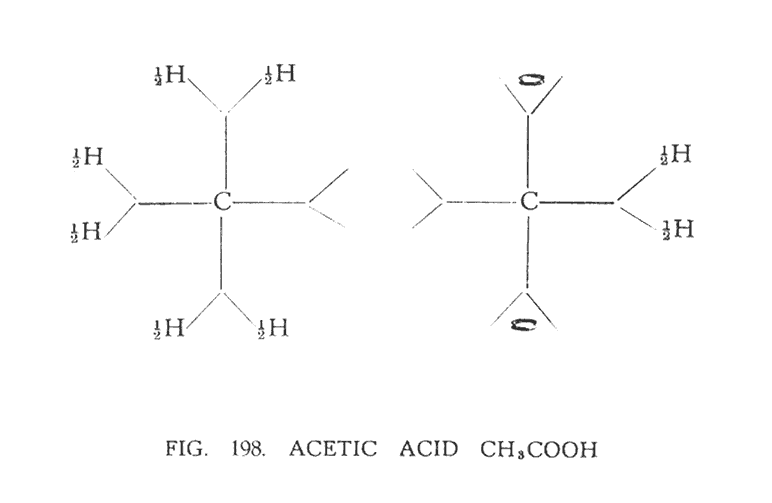
УКСУСНАЯ КИСЛОТА (CH3COOH)
Когда становится очевидно, что валентность углерода распределена между двумя его воронками, положительной и отрицательной, структура уксусной кислоты становится простой. Изобразить ее можно в обычной форме но, принимая валентность каждого атома водорода 1/2, разбивая его на две половины (рис. 198).
Формула, изображенная на (рис. 197) , абсолютно справедлива для двух атомов углерода, если она отражает структуру октаэдра. Первый атом углерода с тремя атомами водорода подобен метану (рис. 192) , если не учитывать один атом водорода. Во втором атоме углерода, кислород занимает такое же место, как и в метиловом спирте (рис. 196) , то есть вертикально и под прямым углом к двум воронкам. В формуле, для того чтобы учесть это символ кислорода "О" помещен горизонтально. Две половины водорода прибывают в цикличном движении над оставшимися воронками углерода. Хотя, если быть точными из-за близости кислорода они немного смещены в его сторону, что отражается на характере их движения.
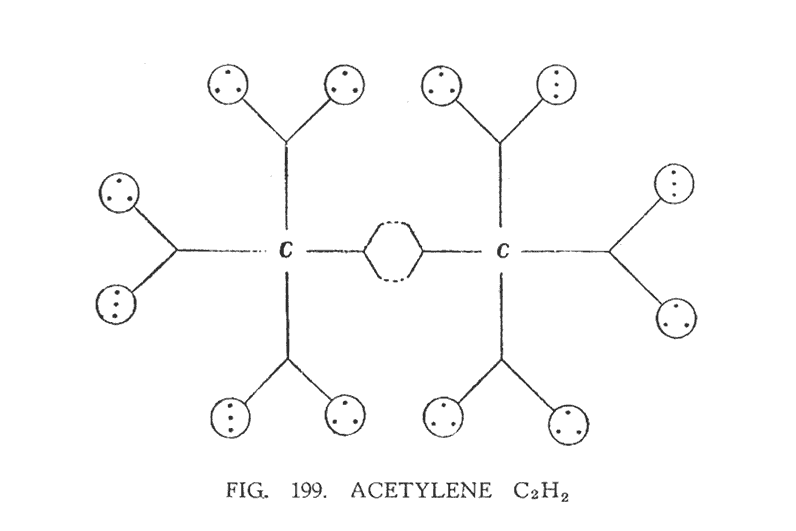
АЦЕТИЛЕН (C2H2)
Ацетилен можно получить, соединив карбид кальция с водой. Когда это произошло, ясновидящий замечает, что кислород направляется к воронкам кальция, в то время как частицы углерода, содержащиеся в воронках, упорядочиваются. Эта самостоятельная группировка представлена на (рис. 199).
Связь между двумя атомами углерода демонстрирует (рис. 197). Четыре воронки углерода, таким образом, полностью исчерпаны такой компоновкой. Два атома водорода, разбитые на двенадцать составляющих, образуют модули. Каждый модуль содержит три Ану. Далее мы наблюдаем двенадцать воронок, образованные от двух атомов углерода. Очевидно, не имеется никакой связи между воронками углерода в молекуле ацетилена.
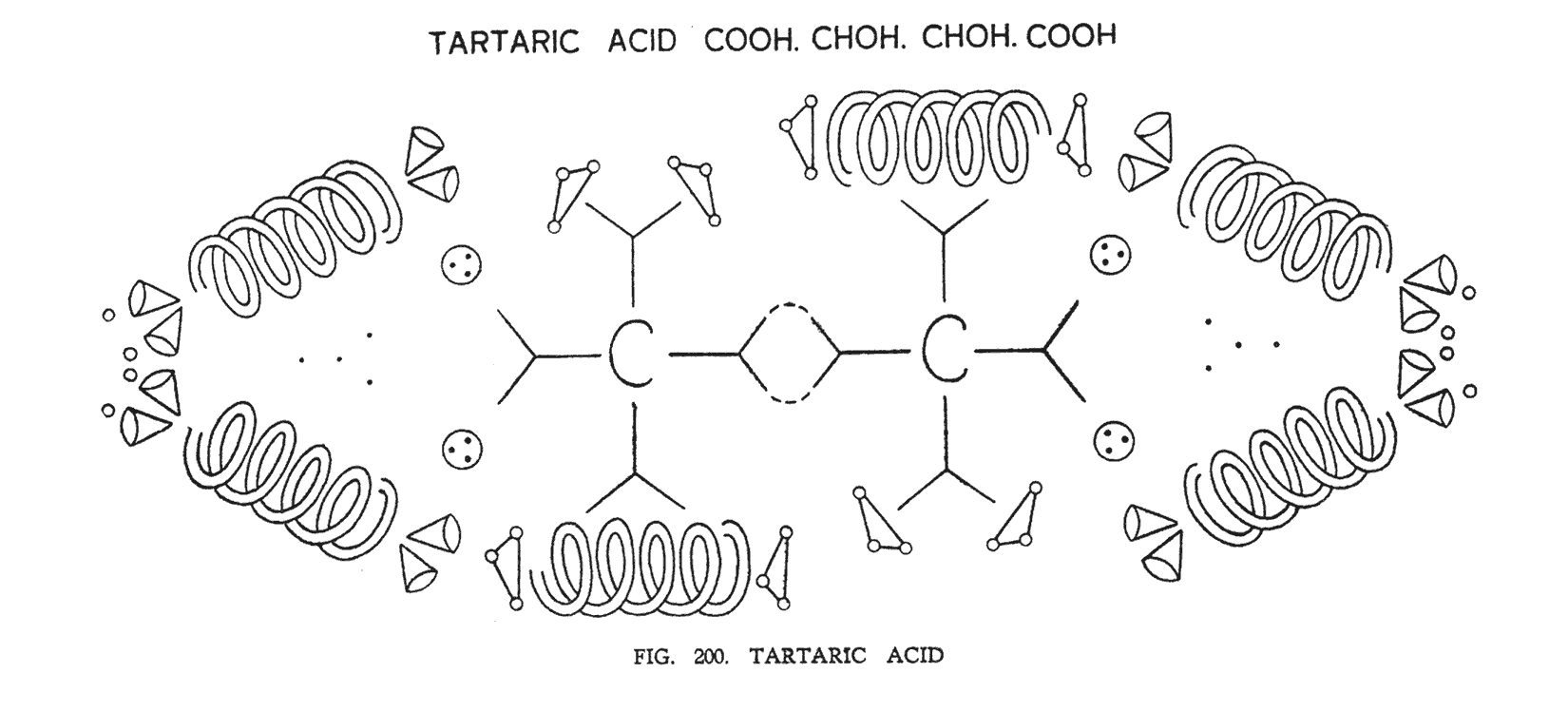
ВИННАЯ КИСЛОТА (COOH CHOH COOH)
Рассматривая винную кислоту, мы имеем симметричную молекулу, две половины которой являются подобными (рис. 200). Два атома углерода находятся в соединении посредствам двух воронок, которые их связывают. Две гидроксильные группы вместе с кислородом самостоятельно группируются с воронками углерода аналогично тому, как мы рассмотрели, изучая метиловый спирт. Известная карбоксильная группа COOH, показывается здесь в форме, которая встречается во многих других кислотах. Стоит отметить, что четыре центральных Ану углерода являются главным центром всей группы, а восемь его воронок занимают место в конце атомов кислорода. Триады, построенные водородом, располагаются между двумя атомами кислорода, а также над двумя воронками центрального атома углерода. Однако эта позиция достаточно не стабильна и точное расположение четырех триад водорода установлено не было.
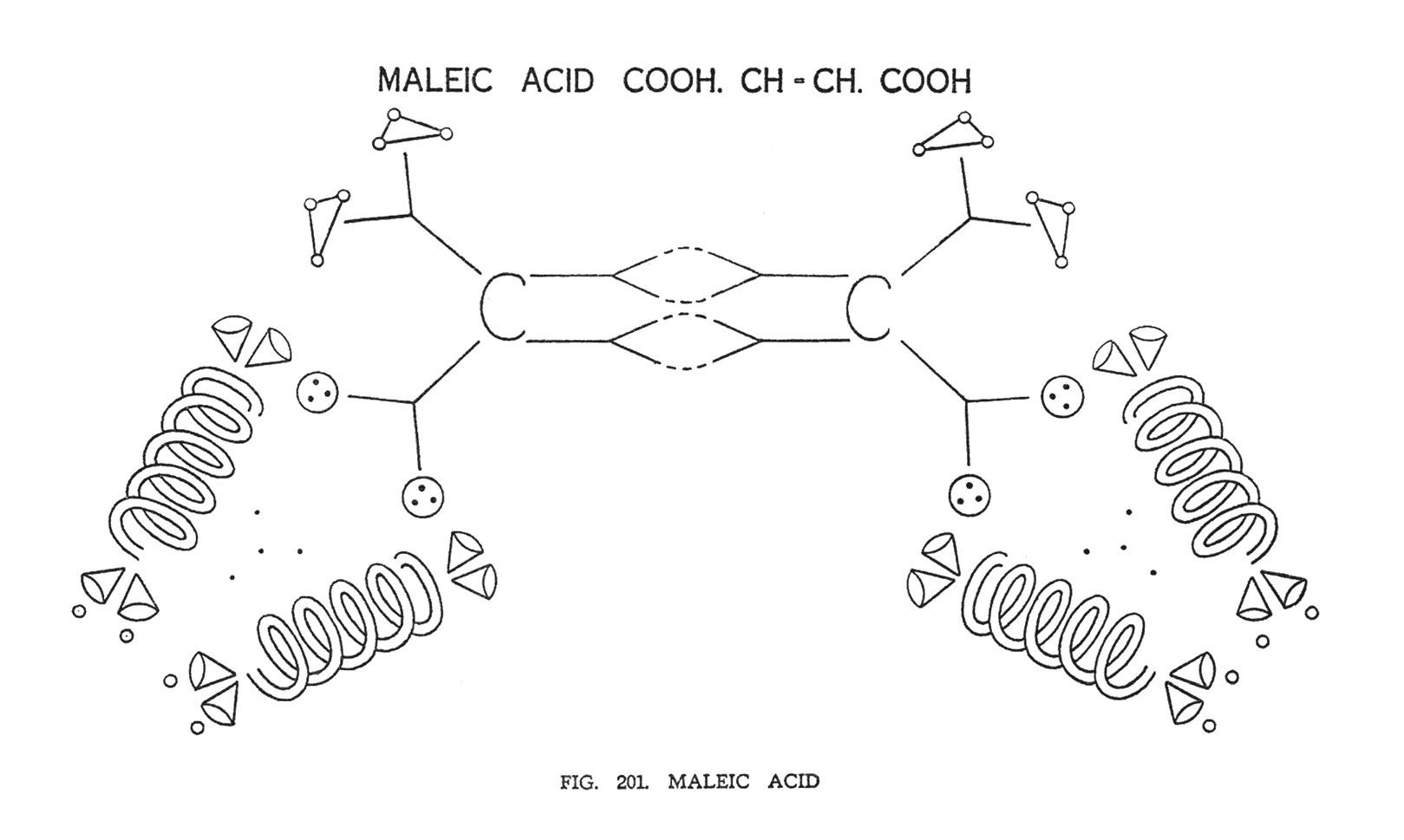
МАЛЕИНОВАЯ КИСЛОТА (C2H2 (COOH)2)
Рассматриваемый состав имеет двойную связь в центре. Это обозначает, что четыре центральные воронки углерода принимают участие в создании этой связи (рис. 201). Таким образом, визуализируя октаэдр, можно сказать, что эта связь полностью захватывает одну его сторону. Остаточная валентность указывает на два угла тетраэдра. Одна пара воронок углерода находится в зоне ожидания водорода, который, как и обычно делится на два треугольника. Другая пара воронок, используя четырехвалентную связь, задерживает карбоксильную группу. Эта группа размещена, точно так, как мы наблюдали, исследуя винную кислоту. Вся система трехмерна. Валентность указывает на углы тетраэдра.
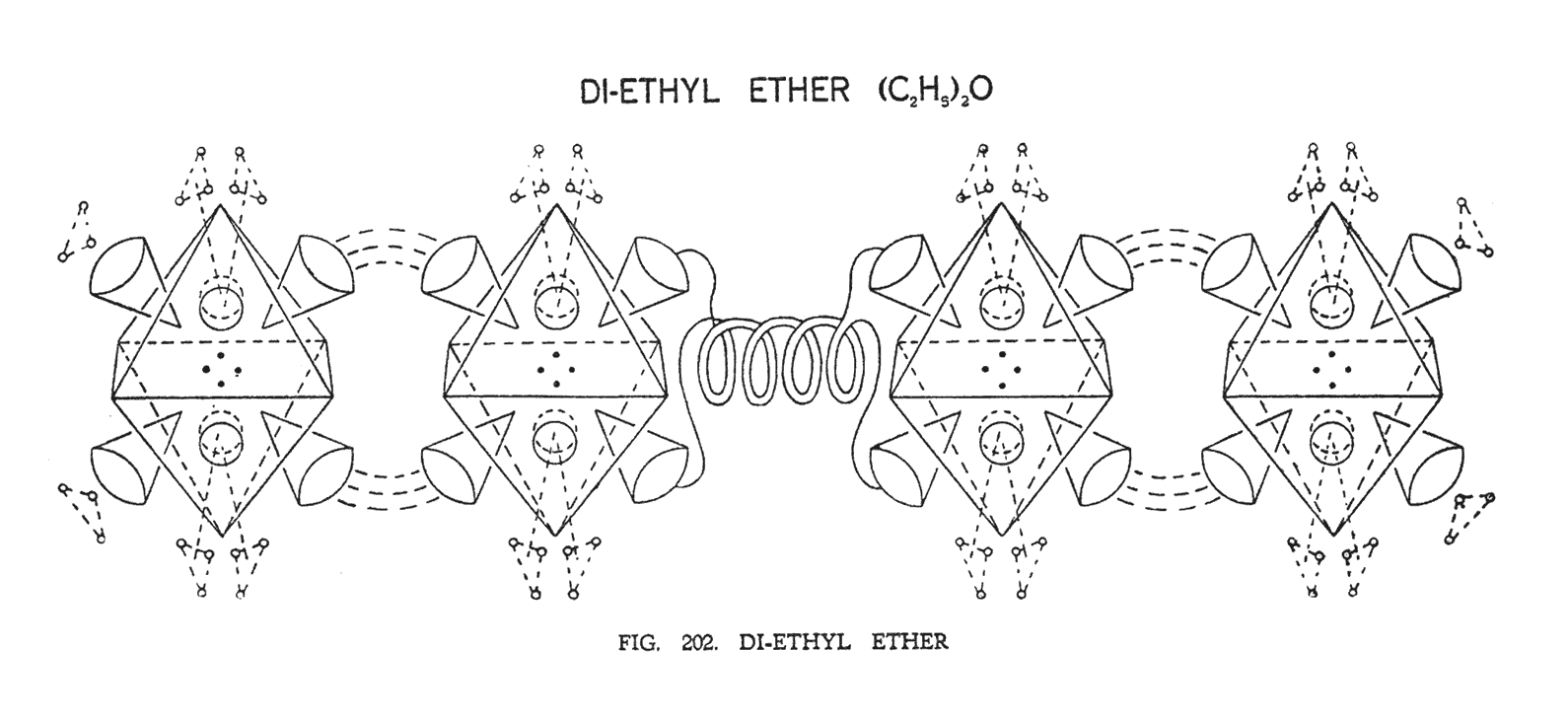
ДИЭТИЛОВЫЙ ЭФИР ((C2Н5)2О)
В эфирах этиловые группы соединяются посредствам кислорода. В примере, представленном на (рис. 202) диэтиловый эфир представляет собой лишь группу эфиров, компоненты которого находятся на том же самом плане.
Молекула, приведенная на (рис. 202), расположена горизонтально, подобно павшей колоне, состоящей из двух групп C2H5, которые связывает между собой атом кислорода. Атомы углерода соединены посредствам четырех воронок, обеспечивающих прочную связь. Отрицательная воронка одного атома углерода связывается с положительной воронкой другого атома углерода, образуя единую структуру.
В Эфирах концы двойной спирали кислорода разводятся, соединяя отрицательную и положительную воронки углерода соответственно. Атом кислорода в результате компрессии приобретает утолщенную форму и становится короче, чем обычно, соединяя две части молекулы воедино. Это происходит потому, что спирали кислорода, переплетены с углеродом уникальным образом, соединяя положительное с отрицательным и наоборот. Таким образом, четыре воронки углерода участвуют в соединении, взаимодействуя с кислородом.
В естественном свободном состоянии для каждого атома и его частей имеется нормальная позиция расположения в пространстве. Атом углерода, например, эмитируя октаэдр, стремится занять строгое фиксированное положение как типичная геометрическая фигура. В нашем случае кислород, взаимодействуя с углеродом, наклоняет вперед его атомы, располагая октаэдр немого наискось. Если бы этого не произошло, молекула бы распалась.
На иллюстрации мы попытались отобразить эту идею, располагая октаэдры надлежащим образом. Четыре видимые воронки обозначены конусами, а четыре скрытые — пунктирными линиями.
Атомы водорода, разбиваясь на треугольники, как в метане, курсируют над воронками углерода, которые не заняты кислородом.
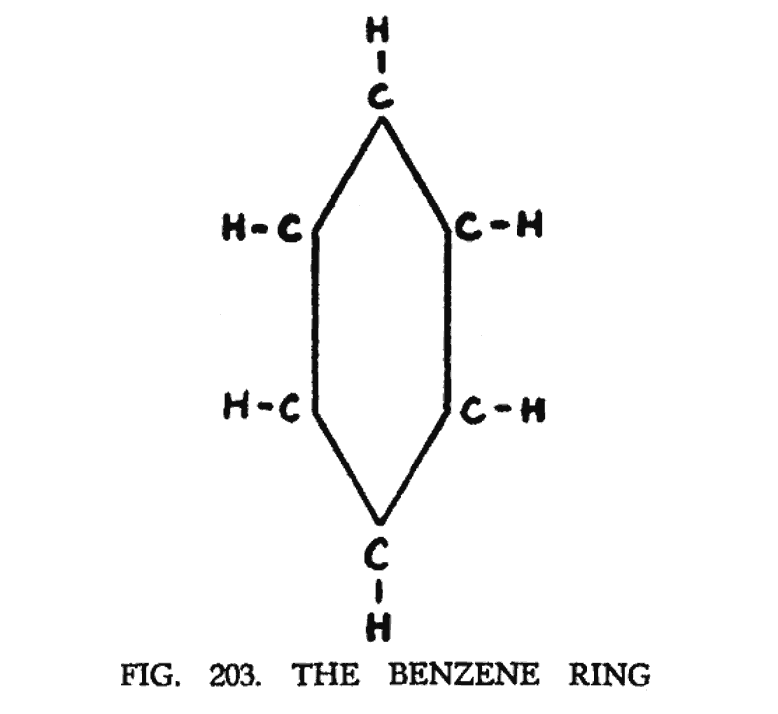
БЕНЗОЛ (C6H6)
Бензол — первый представитель замкнутой цепи или кольцевой группы. Он состоит из шести аридных атомов углерода и шести атомов водорода. Схематически может быть представлен как одиночное кольцо (рис. 203).
Углерод, имеющий четвертую валентность, в молекуле бензола проявляет лишь третью. На что используется остаток?
Ясновидящий замечает, что остаток, который обеспечивается парой воронок, идет внутрь.
В бензоле каждая пара из шести воронок углерода формирует кольцо. Таким образом, двенадцать воронок образуют додекаэдр в его центре. Обратите внимание, что кольцо это не плоский шестиугольник. Шесть атомов углерода, размещаясь в шести углах октаэдра, эмитируют объемную форму. Оставшиеся шесть воронок самостоятельно группируясь, образуют форму веера с шестью триадами от каждого атома водорода, прибывающих над их раструбами.
Фотография модели молекулы бензола изображена на (рис. 204). Мы должны не забывать, что никакая модель не в состоянии адекватно изобразить те процессы, которые в действительности происходят в молекуле. Потому что, во-первых: расстояния между Ану и между группами, а также их относительные размеры, не могут быть правильно отображены в абсолютно любой модели. Во-вторых: каждая воронка, которая выглядит твердым телом, на самом деле таковым не является, а представляет собой лишь вихрь силы. И в третьих: каждый Ану и каждая группа не статичны, а прибывают в непрерывном движении.
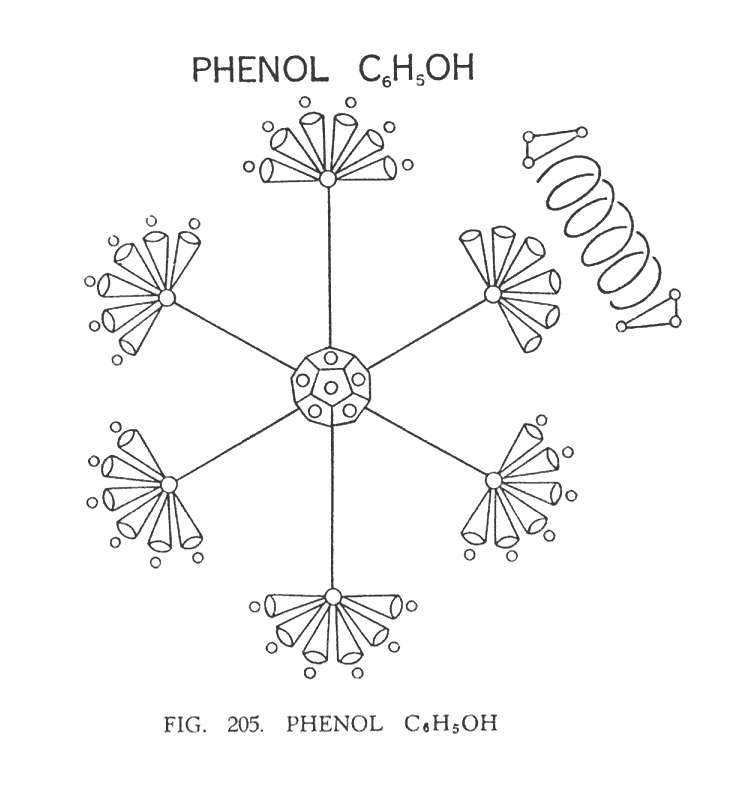
ФЕНОЛ (C6H6 (ОН))
Этот состав — обычная производная бензола. Для того чтобы приступить к изучению фенола, нужно вначале осмыслить структуру бензола, который состоит из центрального додекаэдра и атомов углерода, не вступивших в центральное соединение, которые расположены в углах октаэдра. (Рис. 205) демонстрирует молекулу фенола, в которой шесть атомов углерода лежат в углах плоского шестиугольника. Это сделано лишь для удобства построения диаграмм. Истинная форма фенола такая же, как и бензола, макет которой мы попытались изобразить путем моделирования. Попросту говоря, фенол — это бензол с гидроксильной группой. Гидроксильная группа располагается над одним из углов октаэдра (рис. 205) , а не сверху, как могло бы ожидаться. Молекула фенола асимметрична по сравнению с молекулой бензола. Но различие состоит не в атомах, а в их положении, в котором они находятся относительно потоков сил. Структура фенола искажена, непостоянна и шатка. Наличие кислорода играет огромную роль в происходящих процессах. Когда кислород потерян, фенол снова выравнивается. Создается впечатление облегчения, потери чего-то сковывающего, инородного. Здесь имеется отличный рудимент для сенсации.
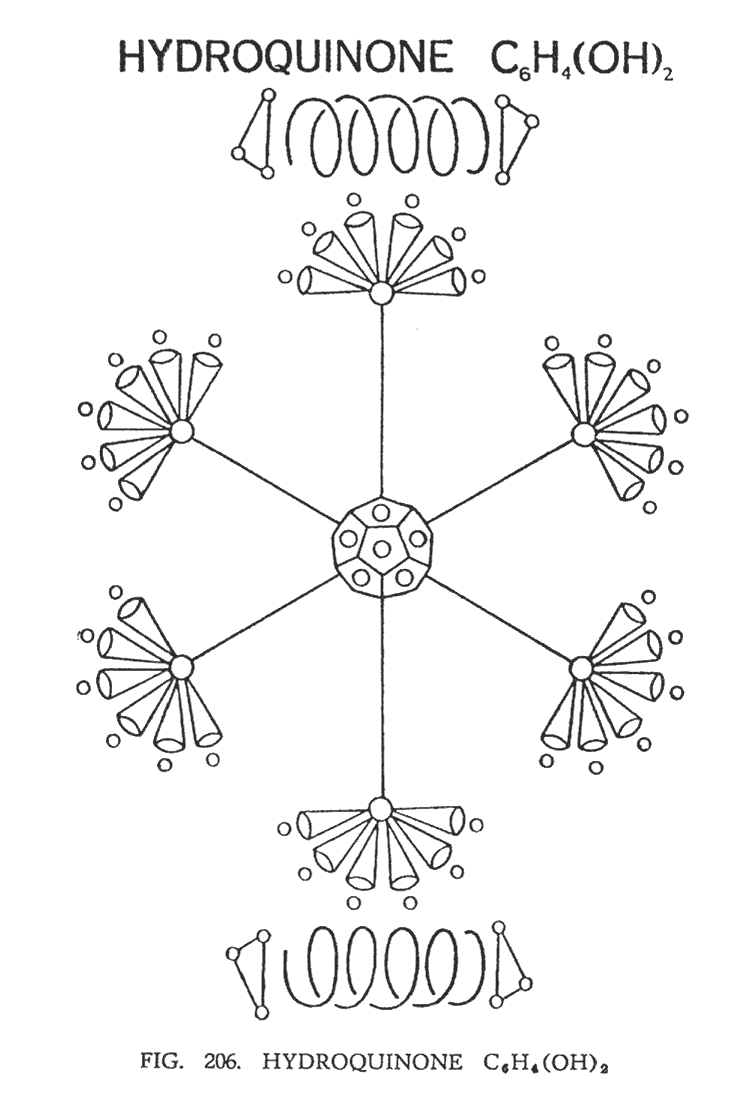
ГИДРОХИНОН (C6H4(OH)2)
Здесь мы имеем две гидроксильные группы, приложенные к бензольному кольцу (рис. 206). Они расположены сверху и снизу от молекулы бензола. Молекула имеет форму октаэдра, как и в бензоле, но за счет влияния кислорода она немного удлинена, однако на стабильность молекулы это не повлияло.
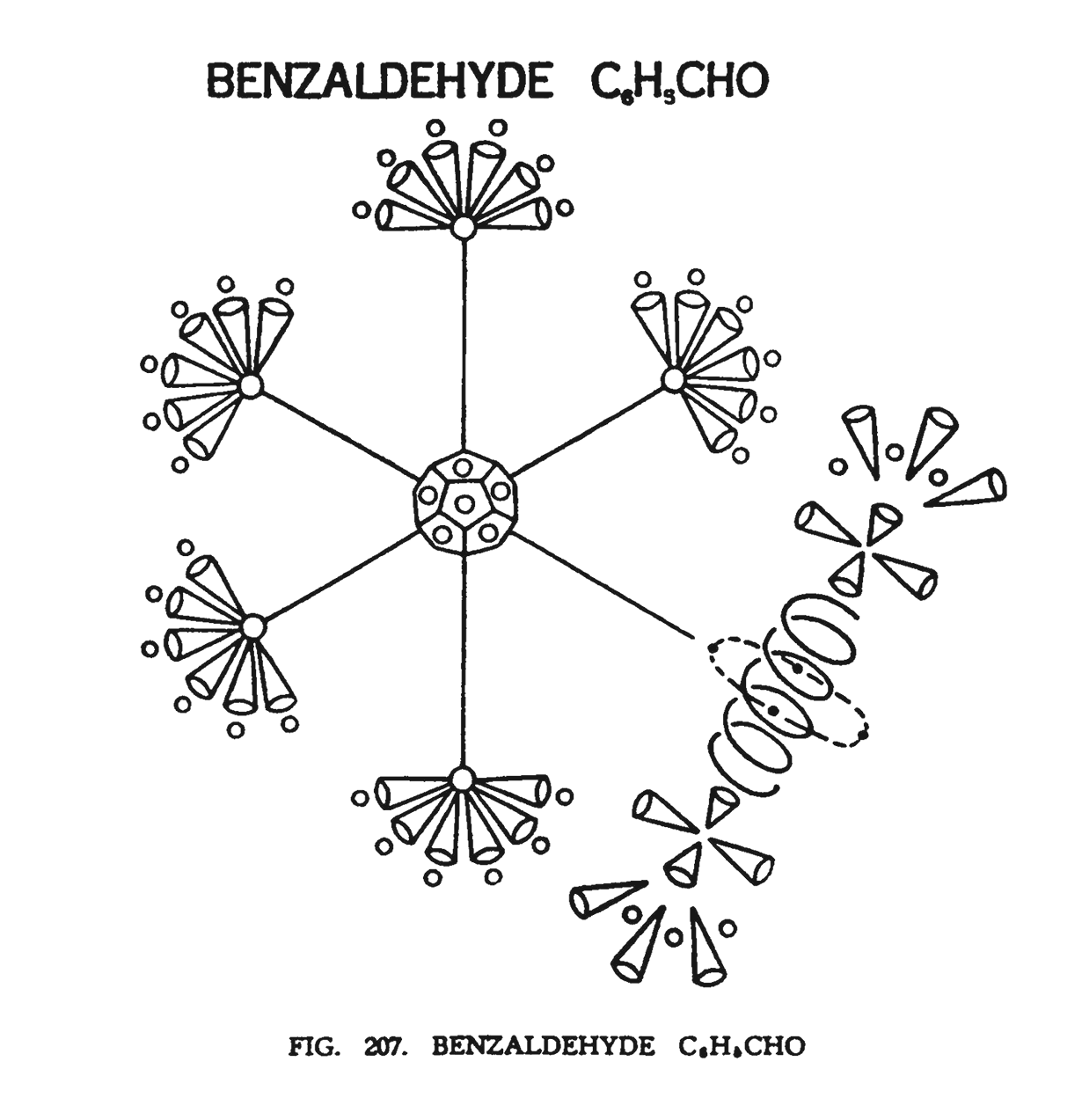
БЕНЗАЛЬДЕГИД (C6H5CHO)
Кольцо, которое мы видим на (рис. 207). построено по прототипу бензольного. Молекула содержит альдегидную группу (CHO), приложенную к одному из углов октаэдра. Весь состав был описан, как обычное шестиугольное кольцо с придатком в одном угле.
Обычное расположение шести воронок углерода (две недостающие воронки используются в центральном додекаэдре) над которыми курсируют шесть маленьких групп водорода Н3, предусматривает стандартную модель бензольного кольца. Однако в нашем случае вместо шести воронок углерода, веерообразно отходящих от центра, в одном из углов октаэдра расположен инородный придаток — альдегидная группа. Этот придаток составлен следующим образом. Средняя часть придатка — атом кислорода. Восемь воронок углерода (CHO) делятся на две группы. Одна группа, состоящая из четырех воронок, располагается над кислородом, а вторая под ним. Четыре соединительных Ану углерода, подобно спутникам, циркулируют вокруг атома кислорода.
Над четырьмя воронками углерода расположились еще три воронки, направленные наружу. Эти воронки от бензольной группы. Шесть сфероидов (H3) расположились между тремя воронками. Они описаны как чрезвычайно активные, действующие снаружи и внутри.
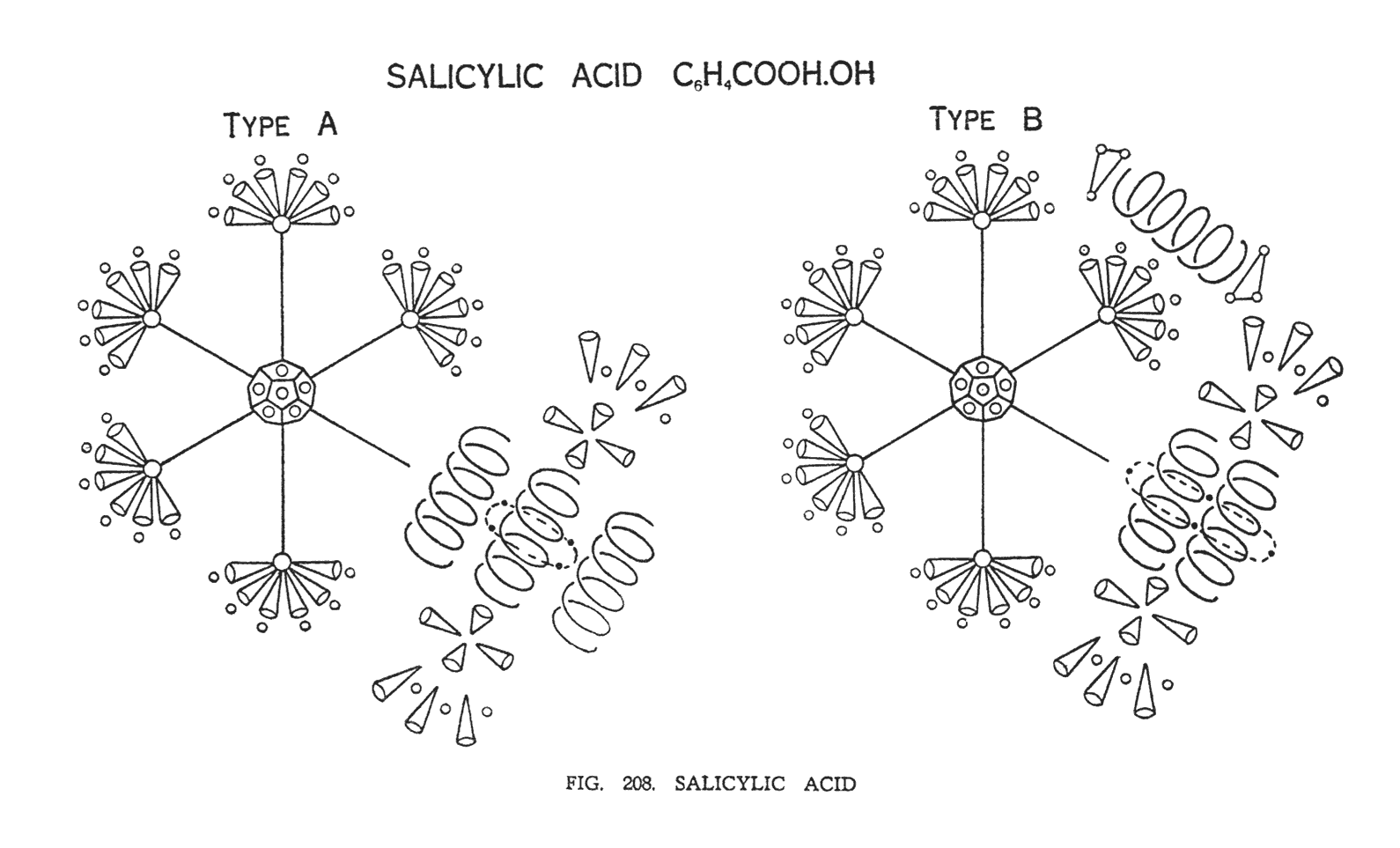
САЛИЦИЛОВАЯ КИСЛОТА (С6Н4СООН (ОН))
Исследуя салициловую кислоту, мы обнаружили две различные модификации этого вещества (рис. 208).
В первой модификации группы COOH и О объединены. Во второй, группа (ОН) отделила свой модуль.
Салициловая кислота — это все то же модифицированное бензольное кольцо, структура которого очень напоминает бензальдегид. Пять атомов углерода, формирующие кольцо, полностью повторяют бензальдегид, но придаток, расположенный в одном из углов октаэдра, увеличился, поскольку три атома кислорода объединились с шестым атомом углерода, и требуют большего пространства для существования. Два атома кислорода вместе с соединительными Ану вращаются вокруг центрального — третьего атома кислорода. На концах атомов кислорода мы наблюдаем четыре воронки углерода, которые относятся к карбоксильной группе. Шесть воронок углерода, принадлежащие к бензольному кольцу, также как в бензальдегиде расположены снаружи. Между этими воронками мы видим шесть сфер водорода, которые относятся к группе COOH.
Во второй модификации гидроксогруппа, также как в феноле, занимает место в углу октаэдра, а группа СООН образует придаток, состоящий уже не из трех, а из двух атомов кислорода.
Возможно, существует еще третья модификация, представляющая собой смесь первых двух.
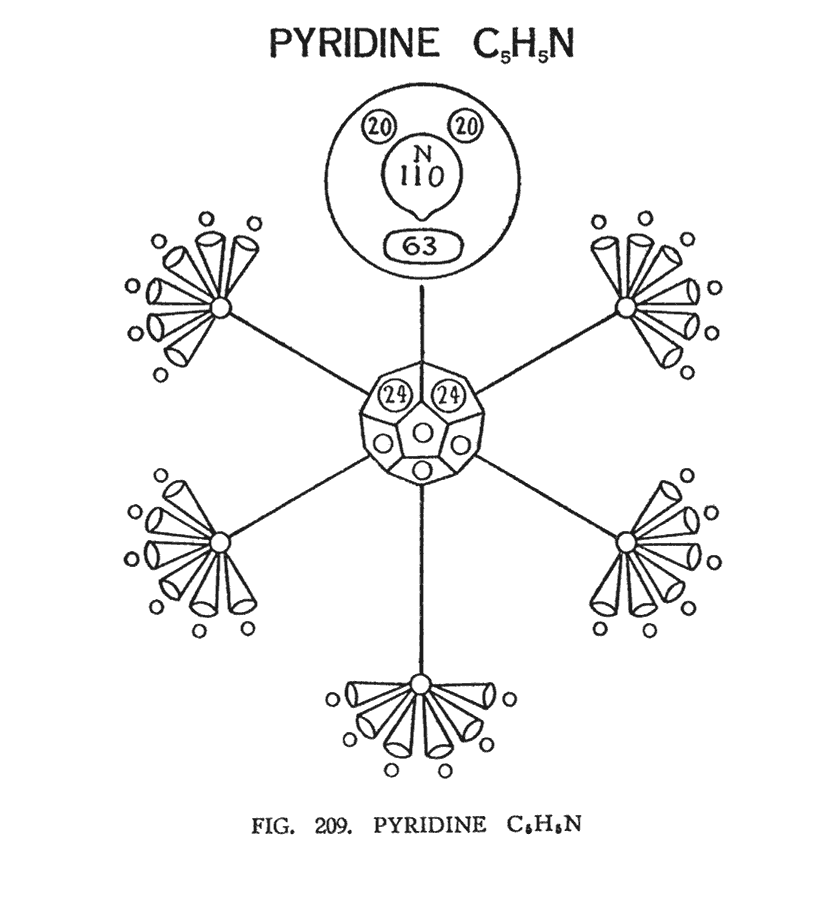
ПИРИДИН (C5H5N)
Пиридин имеет лишь пять атомов углерода, поэтому атом азота формирует кольцо и дополняет шестой атом углерода. Так как пять атомов углерода формируют всего 10 воронок вместо двенадцати, додекаэдр, расположенный в центре, был бы не завершен. Однако, две группы азота (2N24), отделившись от атома, дополнили недостающие звенья. В результате этого получился немного неуклюжий центр, асимметричного характера, чуть-чуть вдавленный со стороны азотистых соединений (рис. 209).
Атом азота, отдавший две свои группы, занимает место шестого атома углерода, замыкая кольцо. Весь модуль в синтезе демонстрирует устойчивую структуру, но процессы, протекающие в системе, выглядят вялотекущими. "Воздушный шар" азота — груша N110, находится на своем обычном месте. Ниже него, как и обычно, находится группа N63. Две группы N20 также остаются на своих местах. Ничего не может быть сказано о том, какую валентность проявляют вещества в этом соединении.
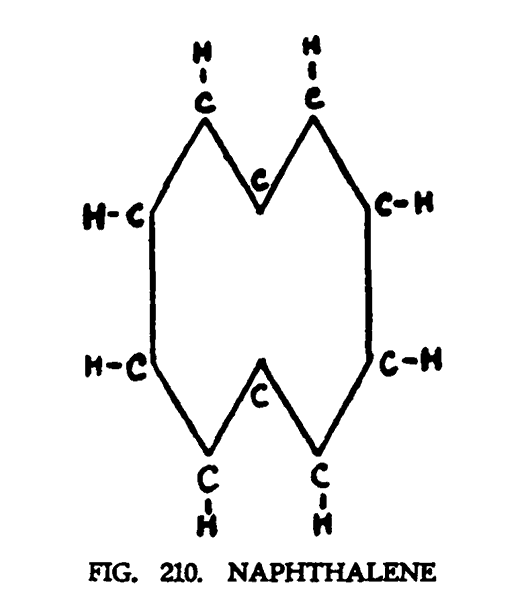
НАФТАЛИН (C10H8)
Химическая формула нафталина — C10H8. Химики имеют длинный постулат, в котором описано расположение атомов углерода и водорода. Графически нафталин можно изобразить так, как показано на рис. 210.
Модель, показанная на (рис. 204). была создана на основании результатов, полученных с помощью ясновидения. На рисунке мы видим симметрично сбалансированную молекулу нафталина, которая имеет близкое подобие двум молекулам бензола, связанных единой системой (рис. 210). Различие состоит в том, что два комплекса, содержащие по шесть воронок углерода, которые отходили от центра додекаэдра, перекомбинировались, формируя пары в крайних точках молекулы. Симметрия молекулы не нарушилась благодаря появлению нового объекта в ее центе. Этот объект составлен из восьми воронок углерода. Воронки, трансформируясь в сферы, легли на каждую сторону октаэдра. Новая группа находится в интенсивном вращении. Изучающий студент сможет легко приступить к изучению нафталина сразу же после того, как усвоит структуру бензола (рис. 204).
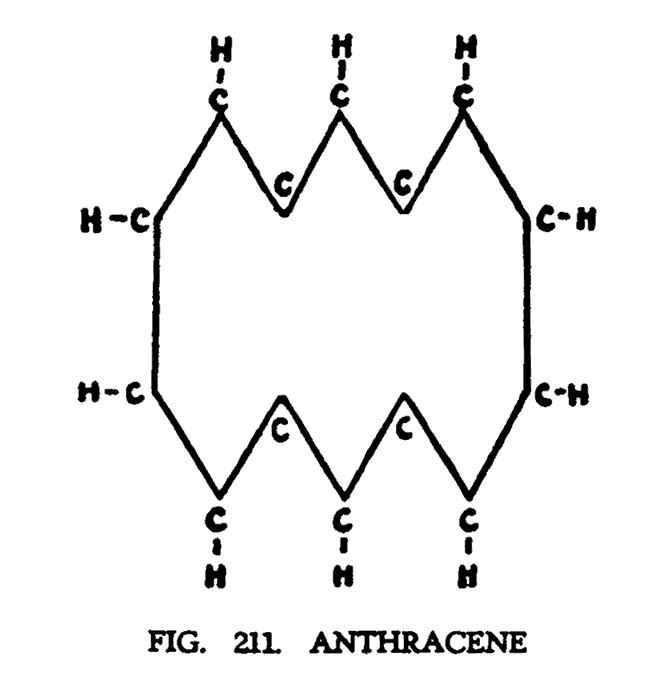
АНТРАЦЕН (C3H10)
Химическая формула антрацена представлена на рис. 211. Антрацен еще не был исследован ясновидением, но его предположительная модель представлена на (рис. 204).
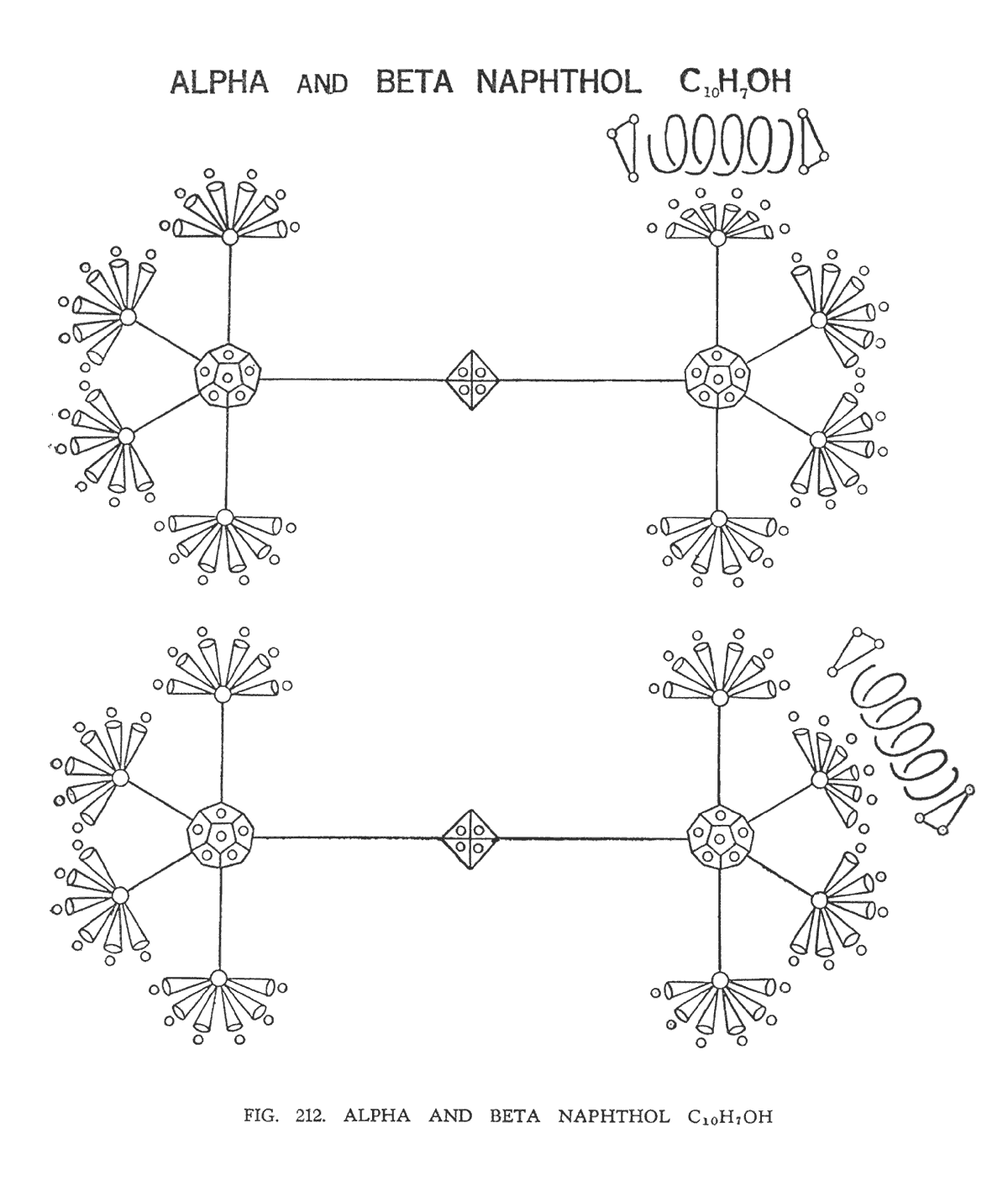
АЛЬФА И БЕТА НАФТОЛ (C10H7OH)
Эти вещества представляют собой производные двойного кольца нафталина.
Единственное различие между альфа и бета нафтолом заключается в том, что гидроксильная группа (ОН) находится сверху в правой части молекулы в первом случае и сбоку во втором (рис. 212).
В описании, данном г. Ледбитером сказано, что шесть воронок углерода, над которыми расположился кислород, кажется, сгладились формируя подушку, на которой кислород покоится как на щётке. Создается впечатление, что атом кислорода немного опущен в результате взаимодействия сил, протекающих через воронки углерода.
В альфа модификации два кольца немного искажены, располагаясь чуть-чуть набок. Там где идет взаимодействие с кислородом кольцо имеет заметно удлиненный вид. В бета модификации второе кольцо перемещено еще больше в сторону взаимодействия кислорода и изогнуто вверх. Вся система и каждая ее отдельная часть автоматически циркулируют, вращаясь вокруг продольной оси. Но бета модификация имеет более шаткую непостоянную характеристику, словно обладает двойной осью. Эти молекулы дают некомфортное чувство напряжения. Они не симметричны и кажутся неестественными.
Каждый из углов кольца шестигранника может обладать собственным магнетизмом, энергии которого достаточно для того, чтобы притянуть атом кислорода. Имеется интересное примечание г. Джинараджадасы, в котором говорится о подробностях размещения кислорода в бета нафтоле. Вероятно возник спорный вопрос в каком именно угле должен разместится кислород в бета модификации. Ледбитер, сосредоточившись, указал именно тот угол, который спустя некоторое время был подтвержден научной теорией.
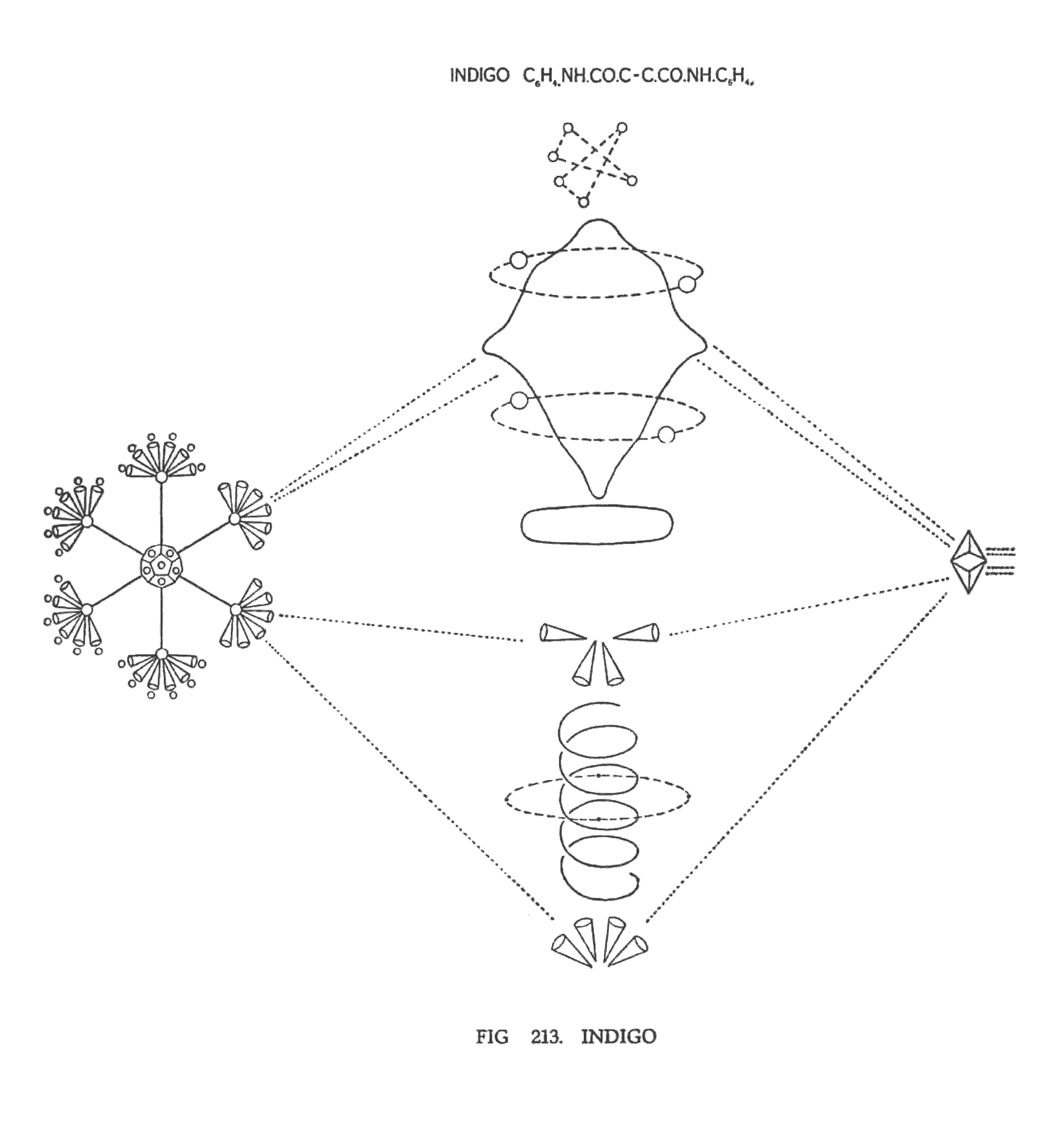
ИНДИГО (C6Н4 NH.CO.C)2
Индиго — сложная молекула (рис. 213), состоящая из четырех колец, но эти кольца не истинно бензольные. Молекула двойная или симметричная; каждая сторона молекулы имеет бензольное кольцо. Кроме него имеется еще дополнительное кольцо, в котором азот, или группа NH, формируют устойчивые связи с близлежащими элементами. Две половины молекулы имеют двойную углеродистую связь. На (рис. 213). изображена лишь одна половина молекулы.
Диаграмма индиго интересна еще тем, что она иллюстрирует действие валентности азота. Группа N110 заметно деформирована, так как она подвержена влиянию сил от других элементов. 2N20 формирует кольцо вокруг верхней части, а 2N24 — вокруг нижней, в которой группа N63 опущена вниз. Две боковые проекции сформированы силами валентности атомов углерода. Атом водорода находится выше азота.
Группа СО размещена в молекуле как окись углерода. Кислород находится в центре, вертикально, подобно столбу, а воронки углерода разместились над и под ним. Четыре соединительные Ану образовали кольцо вокруг атома кислорода. Воронки углерода демонстрируют обычную валентность. Углерод входящий в состав СО имеет пучок воронок, которые расположились подобно закрытому лепестку. Центральная валентность — как в малеиновой кислоте.